реклама
СОДЕРЖАНИЕ НОМЕРА
ОРГАНИЗАЦИЯ ХИРУРГИЧЕСКОЙ РЕАБИЛИТАЦИИ КАК ФАКТОР СОЦИАЛЬНО – ПСИХОЛОГИЧЕСКОЙ АДАПТАЦИИ ПРИАНОФТАЛЬМИЧЕСКОМ СИНДРОМЕ
А.В. Корепанов, С.В. Иванов, Е.А. Ляпин, С.А. Волков, Н.В. Зенина, А.Л. Зайцев, В.В. Ревякина, Е.С. Шишкина
Article is devoted a problem of surgical treatment of anophthalmic desease as complications of traumas of visual organ. New operation is offered.
НОВЫЕ ПОДХОДЫ К ОПТИМИЗАЦИИ ФУНКЦИОНАЛЬНО-ЭСТЕТИЧЕСКИХ РЕЗУЛЬТАТОВ ОКУЛОПЛАСТИЧЕСКОЙ ХИРУРГИИ
Банщиков П.А., Егоров В.В., Смолякова Г.П.
An evaluation was performed and clinical efficacy was shown in utilizing a musculofascial flap in plasty of extensive eyelid defects with the aim to restore the anatomy and function of the lids as well as the orbit following the evisceration with further cosmetic eye prosthesis resulting in the ansence of necrosis and rough scarring contraction of tissues to form a good cosmetic result
читать статью
ОРГАНИЗАЦИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ КАК ПРИМЕР ВАРИАТИВНОГО МЕТОДА В ЭСТЕТИЧЕСКОЙ БЛЕФАРОПЛАСТИКЕ
Н.А. Арефьева, С.А. Волков, А.Л. Зайцев, С.В. Иванов,
Е.А. Ляпин, М.А. Чубаков
At present a stable tendency of the increase of the oncological diseases including appendages of eye is observed. Eyelid tumours are more often located within a musculocutaneous plate and in neglected cases they grow into the subcutaneous fat, eyelid cartilage, conjunctiva and capture the regions adjacent to the orbit. All this creates difficulties for the surgeon both in removing the tumours and in substitutions of eyelid defects of various length and depth
читать статью
ТАКТИЧЕСКИЕ ПОДХОДЫ К ЛЕЧЕНИЮ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ В СОЧЕТАНИИ С ОСЛОЖНЕННОЙ МИОПИЕЙ
Борзунов О.И., Коротких С.А.
Primary open-angle glaucoma (POAG) and complicated myopia (CM) are the main causes of blindness and low vision over the last years. Complicated myopia is encountered in the general structure of myopia at the rate up to 9% [1]. At the same time, a combined course of two presented pathologies in one is of particular interest. According to the data of different authors POAG onset in the eye affected by myopia of II-III degree ranges from 6 to 25% among all patients suffering from glaucoma. When a patient suffers both from POAG and CM the progressing of pathological processes is stipulated by similar pathogenesis components including hemodynamic, hydrodynamic, anatomic and topographic changes in the eyeball [3, 4]. Pathogenesis elements and dystrophic character of both diseases considered, this phenomenon attracts interest in view of combined pathogenetic treatment
читать статью
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В СОСУДИСТОМ РУСЛЕ ГЛАЗА ПРИ ЭКСПЕРИМЕНТАЛЬНЫХ НАРУШЕНИЯХ КРОВООБРАЩЕНИЯ
В.Н.Канюков, С.В. Чемезов, Д.А. Илюхин, А.В. Пряхин
The pathology of the eye vasculature is one of the topical problem in ophthalmology. Blood circulation disorder of the organ of vision is often the cause of blindness and low vision. To establish the symptoms of this pathology allows to timely carry out preventive and medicinal measures. Eye blood circulation is known to have an important function for the organ of vision i.e. a trophic one which alongside with the provision of transparency condition of its optical media feeds the eye receptor apparatus. The reaction of the eye microvasculatue in a number of diseases occurs as far back as the preclinical period and later it is accompanied by pathological changes which lead to the affection of different segments of the eyeball and disorder of visual functions. Despite a large body of research there are insufficient data in literature relating to the condition of vasculature in different variants of blood supply disorder and venous outflow especially in the long-term periods.
читать статью
НОВЫЕ ХИРУРГИЧЕСКИЕ ВОЗМОЖНОСТИ ЛЕЧЕНИЯ СОСУДИСТОЙ И ВОСПАЛИТЕЛЬНОЙ ПАТОЛОГИИ ГЛАЗА
Данилова Л.П., Егоров В.В., Смолякова Г.П., Еманова Л.П., Поваляева Д.А.
The analysis of the perfected method of surgical ohpthalmolymphodetoxication and its efficacy in the treatment of patients with vascular and inflammatory eye diseases was carried out. The period of the patients’ clinical recovery was reduced by 30% on the average and obtained visual acuity on discharge from in-patient hospital exceeded the initial level by 3.2 times
читать статью
ИНТРАОКУЛЯРНОЕ ДАВЛЕНИЕ ПРИ ФАКОЭМУЛЬСИФИКАЦИИ КАТАРАКТЫ С ФЕМТОЛАЗЕРНЫМ СОПРОВОЖДЕНИЕМ
Е.А. Калижникова, О.И. Лебедев, В.А. Жадан, Е.И. Трофимова, В.Е. Зайцева
A Cataract extraction is the most often performed operation in eye surgery. Annually about 19 million people throughout the world undergo this surgery, of whom 3 million people are from the USA. By 2020 according to the estimate of the World Health Organization 32 million people the world over will be having a cataract surgery (7). Phacoemulsification of the cataract at present remains to be a “golden standard” of the cataract extraction surgery. Active mastering of utilizing a femtosecond laser has taken place lately to perform certain stages of the surgery which are characterized by the biggest percentage of complications requiring high precision performance (9). In the course of this surgery after setting the interface upon the patient’s eye surface, a certain level of vacuum in the system is created. This process is characterized by the increase of the intraocular pressure. The duration of the “vacuum stage” of the surgery and accordingly the state of the increased ophthalmotonus are different
читать статью
АНАТОМИЧЕСКИЕ РАЗЛИЧИЯ ДРЕНАЖНОГО АППАРАТА ГЛАЗА КАК ФАКТОР ВОЗМОЖНЫХ НАРУШЕНИЙ ОТТОКА ВОДЯНИСТОЙ ВЛАГИ
И.И. Каган, В.Н. Канюков
The analysis of ophthalmological literature shows that the information of variant microanatomy and microtopography of eye structure may have and applied relevance to etiopathogenesis study of a number of diseases relating to the organ of vision. Outflow disorders of aqueous humour and its extreme forms like glaucoma is a widely spread and severe pathology of the organ of vision (2). On the whole the importance of the eye anatomic peculiarities of the drainage apparatus structure in the development of glaucoma is pointed out in a number of publications (1, 3, 6, 7, 8, 9, 10). This article contains the analysis of the data obtained in microanatomic studies of C.B.Tulupov and A.V.Pryakhin carried out under our guidance (4, 5).
читать статью
РЕГЕНЕРАЦИЯ РОГОВОЙ ОБОЛОЧКИ ПОСЛЕ ХИМИЧЕСКОГО ОЖОГА В УСЛОВИЯХ ПРИМЕНЕНИЯ НАНОСТРУКТУРИРОВАННОГО БИОМАТЕРИАЛА
В.Н. Канюков, А.А. Стадников, О.М. Трубина, О.М. Яхина
In the course of the pilot study there were obtained data showing the optimization of processes of wound zone epithelialization, stimulation of mitotic activity of the basal and prickle cells of anterior epithelium, limitation of apoptotic dominant of epithelial cells and fibroblasts of corneal substance in the conditions of nanostructured biomaterial application, which was also confirmed by immunocytochemical study. The use of nanostructured bioplastic material application at the initial stage of treatment of the chemical burn of cornea contributed to the stabilization of the epithelium-connective relationships in the earlier periods of the experiment, created conditions for acceleration of epithelialization, and also helped to reduce the flow of exudative phase of inflammation, more rapid transition to the final proliferation phase and reduction of rehabilitation terms.
A pathological mechanism of the burn disease is multiple-factor and accompanied by a big number of unfavorable outcomes (2, 3, 5, 6, 7) which are stipulated by the complex of physiological and biochemical changes resulting in the disorder of regenerative processes in the cornea (1). The aim of the treatment in the acute period of the eye burn is as follows: correction of the aseptic inflammation process, acceleration of the eye surface restoration (epithelization), prevention of secondary infection, hypertension control and pain syndrome arrest (2, 5). However conservative treatment doesn’t guarantee a full restoration of the corneal tunic transparency and visual functions due to the development of complications. This brings up the necessity to use surgical methods of treatment such as partial removal of the conjunctiva necrotized areas, coating of the amniotic membrane, transplantation of the limbal stem cells, transplantation of the cultured stem cells of the corneal epithelium in the acute period of the eye burn (1, 2, 3, 7). In the long-term period of the eye burn disease to rehabilitate visual functions a penetrating or lamellar keratoplasty is performed as a rule simultaneously with the reconstruction of the eye anterior segment and if required keratoprosthetics. The success of the surgeries depends on the structure of the formed leukoma (3, 7). Reparative corneal processes are quite sufficiently studied and described, though the problem of the possibility to effect upon them in case of this or that pathology still remains unsolved (5, 8)
читать статью
РЕКОНСТРУКТИВНАЯ ХИРУРГИЯ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ КОЖИ ВЕК И ПЕРИОРБИТАЛЬНОЙ ОБЛАСТИ
А.Н.Демаков, Г.Н.Стрижаков, Е.В.Корчагин, Л.А.Карамчакова
Malignant tumours of the skin including melanoma hold a leading place in the structure of oncological morbidity. Treatment of tumours of the lid skin and periorbital area requires a cooperation of specialists of different trends and it unites two specialists as of oncology and ophthalmology. Surgical treatment of such tumours is possible given special knowledge and skills in the sphere of plastic reconstructive surgery to achieve optimal functional and esthetic results
читать статью
РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОФТАЛЬМОПАТОЛОГИИ
ПО МЕТОДУ АЛЛОПЛАНТ
Федотов А.А., Павлова Н.И.
Chronic degeneration changes of the retina and optic nerve are the most frequent cause of the world irreversible blindness (M.N.Ostrovskaya, 1963). Activation of the body’s regenerative potentialities is the most promising approach to the treatment of this type of pathology. Surgical treatment as per Alloplant method suggests a guided tissue regeneration in patients with different type of ophthalmopathology. Alloplant surgeries have been performed in our clinic since 2005 after training in the Russian Eye and Plastic Surgery Centre and receiving a certificate for the given activity
читать статью
ОТДАЛЁННЫЕ РЕЗУЛЬТАТЫ ПЕРВИЧНОЙ ХИРУРГИЧЕСКОЙ ОБРАБОТКИ ОБШИРНЫХ ПОВРЕЖДЕНИЙ СКЛЕРЫ
С ИСПОЛЬЗОВАНИЕМ ЭНДОВИТРЕАЛЬНЫХ МАТЕРИАЛОВ
Степанянц А.Б., Аладинский Е.Б.
Extensive scleral damages are one of the most severe types of the organ of vision open trauma, and their severity is determined by attendant disorders such as prolapse of inner membranes, loss of the vitreous body etc. resulting in drastic reduction or full loss of visual functions (1, 2). The results of experimental studies and clinical observations showed that the key component of the eye open trauma pathogenesis which determines a severe outcome is a vitreoretinal proliferation. Its basic cause is a pathological fixation of the vitreous body, blood effused into the vitreal space, reaction to alteration and inflammation of intraocular tissues. Pathological membranes, bands fixing to the inner tunics of the eye are formed in the vitreal space. Contractions of pathological structures result in a traditional retinal detachment, ciliary body with further development of phthisis bulbi (3-5). The main problem of the persons who suffered from this type of trauma is the difficulty of the proper matching of the extensive wound edges (on sunbconjunctival rupture of the sclera) especially when they spread to the eye posterior pole and in case of prophylaxis of postoperative complications during the primary surgical debridement. The solution of this problem is topical and specifies the aim of the work
читать статью
Хирургическое лечение орбитальных переломов с применением различных материалов
Сироткина И.А., Бухарина Е.С., Муняев В.В.
In work are presented results operation 58 patients on reconstruction wall and volume of the orbit at different periods with using implants. The immobilization perforated titanium plate used under primary reconstruction fracture. The Late reconstruction was conducted with use allogristle, Alloplants, plastic. The intermediate term of the observation 4,4 ± 1,2 years.
читать статью
ОПЫТ ЗАКРЫТИЯ ДЕФЕКТА КОНЪЮНКТИВЫ В ОБЛАСТИ ФИЛЬТРАЦИОННОЙ ПОДУШКИ ПОСЛЕ АНТИГЛАУКОМНОЙ ОПЕРАЦИИ
А. В. Агафонов, Т. В. Анафьянова, Л. А. Карамчакова
Modern regenerative medicine showed its efficacy if different fields of clinical practices and in ophthalmology, in particular, based on “Alloplant” biomaterials (1, 2). Since 2004 there have been performed about one thousand surgeries in our clinic utilizing Alloplant biomaterials in the treatment of complicated cases of progressive myopia, ambliopia of severe degree and optic nerve atrophy, upper lid ptosis, retinopathy of different genesis, phthisis bulbi, pigmented retinal dystrophy, primary glaucoma, corneal ulcers, neoplasms of conjunctiva, retinal detachments. The use of Alloplant technology in the surgical treatment was more often utilized in case of corneal ulcer with a big area of tissue damage ranging from 33,3% to 100% of the cases (Figure1). A good transplant adaptation and areactive course of the postoperative period were achieved in all cases
читать статью
ВНЕДРЕНИЕ СОВРЕМЕННОЙ ВЫСОКОТЕХНОЛОГИЧНОЙ МЕТОДИКИ – РАДИОВОЛНОВОЙ ХИРУРГИИ – В ПЛАСТИЧЕСКОЙ ОФТАЛЬМОХИРУРГИИ
Филатова И.А.
Perfection of the technologies applied in diagnostics and surgical treatment contributes to the efficacy increase in the rehabilitation of patients. When performing reconstructive surgeries of patients with consequences of traumas inherited or senile pathology as well as with the outcomes of repeated operative interventions, the main task is to achieve a sparing incision, careful hemostasis, minimal damage of surrounding tissues, reduction of edema and postoperative inflammatory reaction. Electro- and diathermocoagulators are used for this purpose. Radiowave surgery is a new up-to-date technology as compared with electrosurgery and diathermocoagulation. A surgical instrument “Surgitron” Ellman Surgitron (USA) based on the principles of radiowave impact upon tissues is widely used in different spheres of surgery. We have implemented this modern technology in a special branch of ophthalmology i.e. plastic ophthalmosurgery
читать статью
ЭКСИМЕРЛАЗЕРНАЯ КОРРЕКЦИЯ ГИПЕРМЕТРОПИИ ПО МЕТОДУ ЛАСЕК
Коротких С.А., Богачев А.Е., Шамкин А.С., Коротких В.С.
Excimer-laser correction of hyperopia is a more complicated and laborious task in comparison with correction of myopia (3). It is connected with a more complex contour of ablation, bigger energy load upon the cornea at the place of the impact, locating closer to the corneal periphery which determines the secondariness of the caused optic effect (1,2). The research data of various authors differ by the choice of the vision correction laser technology (superficial or intrastromal ablation), width of the ablation zone, place of ablation, centering and other parameters (2).
Aim: to estimate the results of hyperopia laser correction performed in the medical clinic “Professorskaya plus”.
читать статью
НОВЫЕ ВОЗМОЖНОСТИ ТЕРАПИИ ВТОРИЧНЫХ ХОРИОРЕТИНАЛЬНЫХ ДИСТРОФИЙ
Хокканен В.М., Карецкий А.В., Лопатина Е.В.
The article presents effects of anoceptin (active substance is comenic acid) in organotypic culture of chick embryo retina and in a model of tuberculous chorioretinitis in rabbits. The protective role of anoceptin for retinal pigment epithelial cells is proved even in a case of such destructive disease as ocular tuberculosis. Considering that retinal pigment epithelium damage is one of the major pathogenic causes of retinal and choroidal degenerative diseases, the applying of anoceptin may prevent its occurrence. Keywords: retinal pigment epithelium, retinal and choroidal atrophy, complications of chorioretinitis, ocular tuberculosis, anoceptin, comenic acid
читать статью
ОПТИЧЕСКАЯ КОГЕРЕНТНАЯ ТОМОГРАФИЯ В ПРИНЯТИИ РЕШЕНИЙ ПРИ ИМПЛАНТАЦИИ СОСУДИСТЫХ РАССАСЫВАЮЩИХСЯ КАРКАСОВ И ОЦЕНКЕ РЕГЕНЕРАЦИИ У БОЛЬНЫХ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
В. В. Плечев, И. Е. Николаева, И. Г. Загитов, И. В. Бузаев,
И. Е. Яманаева.
With increasing use of bioresorbable vascular scaffold (BVS), it is important to understand its expansion characteristics to ensure optimal scaffold deployment. Optical coherence tomography (OCT) has been shown to improve detection of intraprocedural complications. This study aimed to determine whether or not OCT, post successful angiographic BVS implantation, influenced decision making with regard to the need for further scaffold optimization and long term results. For the period 2014-2015 we plan to implant 30 BVS (Absorb, Abbott Vascular), with subsequent visualization and evaluation of the OST. In the control group, installed with conventional x-ray contrast imaging.3 months follow-up phone survey of patients in formalized blank. 12 months follow-up -hospitalization with coronary angiography and OCT. At the time of writing, spent 20 implantations of scaffolds, under 10 OST control and 10 without. 26 BVS were implanted, 14 of them in the group with OST and 12 in the control group. In the experimental group in 3 cases out of 10 identified suboptimal results, requiring subsequent correction. In the early postoperative period, we observed no complications by the endpoint, all patients were discharged according to plan and without pain. Further, after 3 months, we conducted telephone interviews with patients, using a standardized survey design. Of the interviewed 20 patients, there was no one outcome by the end point, no patient was noted pain syndrome. Despite its revolutionary method of intravascular restoration with the use of absorbable coronary frames requires careful preparation and intraoperative monitoring. Even the preliminary results of our study suggest the preferential use of the techniques of intravascular imaging to assess the extent of disclosure, availability zones dissection, thrombosis and eccentricity scaffold. The final conclusions of our work we plan to submit at the end of 2015.
читать статью
 на главную страницу
на главную страницу
-реклама-
 вернуться на главную страницу
вернуться на главную страницу
ОРГАНИЗАЦИЯ ХИРУРГИЧЕСКОЙ РЕАБИЛИТАЦИИ КАК ФАКТОР СОЦИАЛЬНО – ПСИХОЛОГИЧЕСКОЙ АДАПТАЦИИ ПРИ АНОФТАЛЬМИЧЕСКОМ СИНДРОМЕ
А.В. Корепанов, С.В. Иванов(1), Е.А. Ляпин(1), С.А. Волков(1), Н.В. Зенина(1), А.Л. Зайцев(1), В.В. Ревякина(2), Е.С. Шишкина(3)
Ижевская Государственная медицинская академия,
1 - Республиканская офтальмологическая клиническая больница , г. Ижевск
2 - ГУ Минюста РФ по Республике Крым и Севастополю, г. Красноперекопск
3 - Территориальный орган Федеральной службы по надзору в сфере здравоохранения и социального развития по Удмуртской Республике, г. Ижевск
Статья посвящена проблеме хирургического лечения анофтальмического синдрома – как осложнения травм органа зрения. Предложена новая двухэтапная методика операции.
Актуальность. Травма органа зрения в современных условиях ежегодного увеличения числа катастроф и локальных военных конфликтов, криминального и бытового травматизма, составляет от 2 до 15% всего количества травм [8] и характеризуется как сочетанностью, так и возрастанием удельного веса тяжёлых проникающих ранений и тяжёлых контузий глаз. Подобные повреждения, по данным различных авторов, составляют 12 – 39% всех травм органа зрения и в 72,2% приводят к гибели глаза [5]. Совершенствование микрохирургической техники и использование современных лекарственных препаратов - несомненные успехи медицины в целом, тем не менее, не всегда позволяют офтальмологам сохранить глаз как анатомический орган. Количество энуклеаций в России составляет 8000 – 12000 в год .
Асимметрия верхней половины лица за счёт отсутствия глазного яблока, деформация век, западение всей глазничной области — типичная картина АС после ранений. Развитие синдрома в период рубцевания при нарушении нормальных соотношений анатомических структур глазницы неуклонно прогрессирует [3] вследствие изменения обмена биополимеров соединительной ткани (Е.Г. Бутолин, 1983, 1993) при стрессе. Вызванный травмой и косметическим дефектом психоэмоциональный стресс приводит к различным нейроэндокринным и вегетативным реакциям, в зависимости от индивидуальной стрессрезистентности [9, 10], обусловленной влиянием преобладающего тонуса вегетативной нервной системы [7]. Соматическая реакция проявляется в обострении хронических и провоцировании свежих случаев заболеваний, а психологическая – в длительных судебных тяжбах по жалобам на качество оказанной медицинской помощи и искам о возмещении морального ущерба [1,12], либо - в полной социальной дезадаптации [11].
Цель. Показать результаты двухэтапной операции по поводу анофтальмического синдрома после ранений у группы больных.
Материалы и методы. Нами прооперировано 73 больных с АС после ранений в возрасте от 15 до 74 лет. По сравнению с одноэтапными, как показал опыт работы, практикуемая нами двухэтапная операция даёт лучшие результаты. Первый этап — создание опорно-двигательной культи: разрез конъюнктивы производится от одного угла глазной щели до другого, глубоко по дну полости, сохраняя конъюнктиву хотя бы на 4-5 мм у спаек век. Отсепаровка тканей производится до вершины глазницы, желательно тупым путём, с последующим введением аллотрансплантата хряща размером 8-12x10-15 мм в зависимости от размеров глазницы. На рану конъюнктивы дна полости накладываются без натяжения биошвы. В конъюнктивальную полость вставляется глазной протез, соответствующий размерам глазницы. Над протезом накладываются двухъярусные швы: первый ярус - на рану конъюнктивы без натяжения, второй ярус - на края век. Для оттока секрета у одной из спаек шов не накладывается. Допускается натяжение тканей под протезом. При значительной деформации (западения) век, вследствие атрофии ретробульбарной клетчатки, создаются подкожные туннели в толще век ближе к краям глазницы (верхнему и нижнему), в которые вводятся тонкие пластинки аллохряща. Местно вводят антибиотики. Швы снимаются на 14 — 18 день. Второй этап операции производится через год: производится сквозной разрез по линии сросшихся век. На края разреза накладываются несколько направляющих швов. Глазной протез ежегодно меняют на больший по размеру. Важным условием хорошего косметического эффекта является не только правильно подобранный и изготовленный глазной протез, но и процесс адаптации к нему, обеспечиваемый качественным эффективным уходом за конъюнктивальной полостью и глазным протезом [2].
Результаты и обсуждение. Процесс адаптации к глазному протезу реализуется через метаболические, иммунобиологические и психологические механизмы патогенеза. Группа метаболических механизмов адаптации связана с наличием прямого повреждающего воздействия протеза на слизистую оболочку. Как эпителий, так и подлежащая соединительная ткань начинают воспринимать локальное повышение давления, принимая на себя нефизиологичную для этой зоны механическую нагрузку. Также при наличии качественно сформированной культи прекращается свободный доступ воздуха в пространство под протезом. Кроме того, нарушается нормальный теплообмен, чему способствует низкая теплопроводность конструкционных материалов протеза. Описанные феномены вызывают стойкое рефлекторное расширение капилляров, выражающееся клинически разлитой гиперемией слизистой. Иммунобиологические механизмы адаптации к протезам связаны с сенсибилизацией организма к химическим или бактериальным токсинам. При применении протеза изменяется нормальный биоценоз конъюнктивальной полости, что является триггерным фактором для «запуска» иммунной реакции на бактериальные токсины или компоненты пластмассы, так как конъюнктива является активной иммунной зоной организма. Психологическая реакция на наличие инородного тела в конъюнктивальной полости реализуется через постоянную афферентную импульсацию в кору головного мозга с рецепторов слизистой, способствуя формированию доминанты (часто болевой), и увеличивает сроки адаптации к протезу. В целом механизмы адаптации являются единым процессом, позволяющим организму нормально реагировать на инородное тело – протез глазного яблока. Отдалённые исходы у 67 больных проверены в сроки наблюдения до 15 лет, у всех пациентов результат операции был вполне удовлетворительным: протез не выскальзывает, веки слабо подвижны. У всех больных нормализовался психологический статус, повысилась самооценка, снизился уровень личностной тревожности [11].
Вывод. Таким образом, двухэтапная реконструктивная операция при АС после ранений даёт благоприятные косметические исходы и, стабилизируя психологический статус, заслуживает внимания и дальнейшего изучения как один из методов реабилитации пострадавших.
Литература
- Баринов Е.Х., Тихомиров А.В. Судебно – медицинская экспертиза при решении вопросов, связанных с «медицинскими» спорами // Медицинская экспертиза и право. – 2010. - № 6. – С. 5 – 7.
- Басова Г.Г., Абзалов А.Р., Терлецкая Е.Н. и др. Способ обработки стеклянных глазных протезов с дезинфицирующей целью // Межрегиональная научно – практическая конференция «Актуальные проблемы офтальмологии»: Материалы. – Кемерово, 2010. – С. 202 – 204.
- Волков С.А., Кубарева И.А., Зайцев А.Л. и др. Анофтальмический синдром // Российская научно – практическая конференция офтальмологов «Ижевские родники – 2008»: Материалы. – Ижевск, 2008. – С. 665 – 666.
- Гундорова Р.А. Вопросы эпидемиологии и реабилитации лиц с анофтальмом на территории РФ // Вестник офтальмологии – 2007.– Т. 122, № 3. – С. 42 – 46.
- Гундорова Р.А., Филатова И.А. Анализ исходов тяжёлых проникающих ранений и контузий глаз при наличии необработанных или неадекватно обработанных разрывов склеры // Международная научно – практическая конференция по офтальмохирургии «Восток - Запад»: Материалы. – Уфа, 2010. – С. 257 – 259.
- Зайкова М.В., Тихомирова Н.М., Зенина Н.В. Возрастные особенности органа зрения в норме и при патологии у детей. Восстановление конъюнктивальной полости при анофтальмическом синдроме. – Москва, 1990.– С. 68 – 71.
- Кубарева И.А., Смелышева Л.Н. Влияние преобладающего тонуса вегетативной нервной системы на аккомодационную функцию глаза у студентов при действии эмоционального стресса // ВЕСТНИК Оренбургского Государственного Университета – 2010. – № 12.// Межрегиональная научно - практическая конференция «Новые технологии микрохирургии глаза»: Материалы. – Оренбург, 2010. – С. 115–119.
- Пашинова Н.Ф., Першин К.В. Офтальмотравматология в медицине катастроф // Сборник научных трудов НИИГБ им. ГЕЛЬМГОЛЬЦА. - М.,- 1994. - С. 18 – 19.
- Судаков К.В. Системные механизмы эмоционального стресса. – Москва: Медицина, 1981. – 232 с.
- Судаков К.В. Пластичность системных механизмов мозга // Успехи физиологической науки. – 1996. – Т. 27, № 2. – С. 3 – 27.
- Терлецкая Е.Н., Левинская Э.Н. Особенности психологического статуса больных с анофтальмом // Межрегиональная научно – практическая конференция «Актуальные проблемы офтальмологии»: Материалы. – Кемерово, 2010. – С. 204 – 205.
- Тимофеев Д.Н. Сравнительная оценка результатов судебно – медицинских и клинических экспертиз оценки качества офтальмологической помощи // Межрегиональная научно – практическая конференция «Актуальные проблемы судебной медицины и экспертной практики»: Материалы. – Суздаль, 2009. – С. 39 – 41.
- Тихонов С.Г. Характеристика анофтальма и тактика оказания глазопротезной помощи в современных условиях // Методическое пособие для врачей – офтальмологов.- Красноярск, 2008.
к содержанию опубликовать статью
НОВЫЕ ПОДХОДЫ К ОПТИМИЗАЦИИ ФУНКЦИОНАЛЬНО-ЭСТЕТИЧЕСКИХ РЕЗУЛЬТАТОВ ОКУЛОПЛАСТИЧЕСКОЙ ХИРУРГИИ
Банщиков П.А. Банщиков Павел Александрович – врач-офтальмолог, заведующий отделением реконструктивно-восстановительной хирургии Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России.(1), Егоров В.В.д.м.н., профессор, директор Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России, заведующий кафедрой офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края (1,2), Смолякова Г.П. д.м.н., профессор, врач-офтальмолог клинико-экспертного отдела Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, профессор кафедры офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края (1,2)
1 - Хабаровский филиал ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России
2 - КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края
Проведена оценка и показана клиническая эффективность использования мышечно-фасциального лоскута при пластике обширных дефектов век с целью восстановления анатомии и функции век, а также орбиты после экзентерации с целью последующего косметического глазного протезирования, результатом которого явилось отсутствие некроза и грубого рубцового сокращения тканей с формированием хорошего косметического результата.
Ключевые слова: окулопластика, экзентерация, субкутанный мышечно-фасцальный лоскут
Key words: oculoplasty, evisceration, subcutaneous musculofascial flap
Актуальность. Обширные дефекты век наиболее сложны для окулопластической хирургии в связи с морфологическими особенностями утраченных тканей, ограниченными возможностями получения необходимого пластического материала, отвечающего анатомическим и эстетическим требованиям [1, 2, 9, 11, 12]. Пластика обширных дефектов век усложняется особенностью рельефа орбитальной и периорбитальной областей, строением связочного аппарата и наличием активной мимической зоны, способной за счет негативного влияния окружающей и подлежащей мускулатуры вызывать деформации трансплантата в зоне операции.
Наиболее частой причиной обширных дефектов век является удаление опухолей, травмы [3-7, 10, 13].
Все виды хирургических вмешательств по восстановлению век, направлены, прежде всего, на формирование каркаса. Выбор метода пластической реконструкции век зависит от размера дефекта, степени эластичности и растяжения тканей век, связочного аппарата, а так же периокулярной области [8, 15, 16]. Для закрытия небольших дефектов век, не превышающих четверти его длины, обычно используют перемещенные кожно-мышечные лоскуты. Обширные дефекты требуют для своего закрытия тканевых лоскутов сложной композиции и больших размеров, приживление которых может сопровождаться грубым рубцеванием, сморщиванием трансплантата и необходимостью выполнения повторных реконструкций. В связи с этим первостепенной задачей на сегодняшний день остается, прежде всего, поиск донорской зоны, для получения тканевого трансплантата любых размеров, использование которого в офтальмопластике не влечет за собой негативных последствий с анатомической и косметической точек зрения и позволяет существенно снизить риск его рубцевания, сморщивания и сокращения.
Другим, не менее трудным, разделом глазной пластической хирургии является формирование тканевого ложа для протезирования с целью косметической и социальной реабилитации пациентов после экзентерации орбиты.
Существующие до сих пор методы подготовки орбиты к косметическому протезированию с использованием слизистых, либо кожных аутотрансплантатов остаются несовершенными. В анамнезе таких больных обычно отмечаются ранее проведенные хирургические вмешательства, которые еще в большей степени способствуют развитию рубцовой ткани в полости глазницы. Это приводит к невозможности ее дальнейшего протезирования, что нарушает косметику лица и приводит к глубоким психологическим страданиям человека. Поэтому для создания необходимых условий с целью протезирования орбиты актуален поиск пластического материала отвечающего требованию косметического благополучия [14].
Для оптимизации качества медико-социальной реабилитации больных с обширными дефектами век и реконструктивной пластики орбиты после экзентерации, в Хабаровском филиале ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России с 2009 г. стали использовать субкутанный ротированный мышечно-фасциальный лоскут на питающей ножке, сформированный из височной мышцы.
Идея использования фациальных и мышечных лоскутов височной зоны в пластической офтальмохирургии принадлежит русскому ученому С.С. Головину [2].
Вместе с тем возможности височной мышцы для пластической хирургии обширных дефектов век и орбиты после экзентерации, практически не освещены в отечественной офтальмологической литературе.
Цель – оценить клиническую эффективность хирургии обширных дефектов век и пластики обиты после экзентерации при использовании субкутанного мышечно-фасцального лоскута с виска.
Материалы и методы.
Объектом исследования явились 17 пациентов (17 глаз), среди них 12 пациентов с обширными дефектами век и 5 пациентов после экзентерации орбиты. По площади дефекта все пациенты были разделены следующим образом: 3 человека (25%) с полным отсутствием века и связочного аппарата, 5 человек (41,6%) с сохранением только медиальной связки и внутренней 1/3 века, 4 пациента (33,4%) с сохранением медиальной и латеральной связки века. Причинами обширных сквозных дефектов век явились: у 3 пациентов – термическое поражение III-IV степени, у 4 пациентов – травматический отрыв (медвежья травма и вследствие ДТП), а у 5 пациентов – удаление распространенного базальноклеточного рака (БКР) T3-T4 стадии. Возраст пациентов варьировал от 31 до 82 лет (медиана – 52,8 лет).
Всем пациентом выполнено замещение дефекта века путем субкутанного ротирования височной мышцы в зону колобомы с фиксацией его к остаточному связочному аппарату или надкостнице орбитального края.
Для восстановления конъюнктивального дефекта использовали различные ткани: аллоконъюнктиву – у 3 пациентов; мукопериостальный лоскут с верхнего неба – у 7 пациентов; слизистую с губы – у 2 пациентов. Для восстановления кожного покрова над трансплантатом у 4 больных использовали перемещенный кожный лоскут на питающей ножке из окружающих зон лица, у 8 больных использовался свободный кожный трансплантат идентичный по своей конфигурации и протяженности, сформированный из ретроаурикулярной зоны (3 пациента), либо в области внутренней поверхности плеча (5 пациентов).
Причиной экзентерации орбиты у 4 пациентов явились увеальная меланома (T4N0M0), вышедшая за пределы глазного яблока в ткани орбиты, а у 1 пациента имела место рабдомиосаркома орбиты (T3N0M0). Возраст пациентов составил 40-65 лет (средний возраст 52±10,5 лет).
Экзентерацию проводили по стандартной технологии, руководствуясь основными принципами офтальмоонкологии и офтальмохирургии, у всех пациентов сохраняли только кожно-мышечный слой век. После удаления опухоли единым блоком с орбитальными тканями, проводили формирование мышечно-фасциального лоскута на ножке нужного размера, который состоял из височной мышцы, поверхностной темпоро-париетальной фасции и поверхностной собственной фасцией височной мышцы. Вершину орбиты тампонировали гемостатической губкой, поверх которой укладывали ротированный мышечно-фасциальный лоскут и фиксировали его к внутренней связке век или надкостнице внутреннего орбитального края, формируя заднюю стенку орбиты. Края лоскута сшивали непрерывным швом с раневой поверхностью век. В сформированную полость устанавливали глазной протез и накладывали временную блефарорафию.
Формирование субкутанного височного мышечного лоскута, как для пластики век, так и орбиты проводили по одинаковой технологии, после вертикального разреза кожи до 8 см в предушной зоне позади роста волос. Кожный лоскут с подкожно-жировой клетчаткой отслаивали по направлению к наружному краю орбиты, височной и скуловой кости с обнажением поверхностного листка темпоро-париетальной фасции. Обнаженный мышечно-фасциальный лоскут отсекали в области прикрепления у височной кости, выкраивая по ходу мышечных волокон тканевой трансплантат нужных размеров и ротировали его в зону дефекта (рис. 1.).
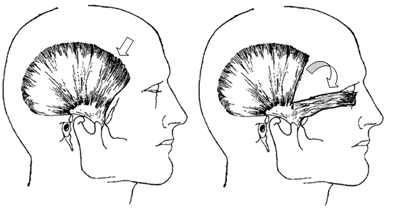 |
| Рисунок 1. Выкраивание и ротирование субкутанного мышечно-фасциального лоскута с виска в зону сквозного дефекта нижнего века |
Использование мышечно-височного лоскута в качестве пластического материала, было обусловлено особенностям его анатомического строения и кровоснабжения из двух сосудистых систем (поверхностной и глубокой височной артерии), что минимизирует риск возникновения некротических изменений и рубцовых сокращений (рис. 2).
| Рисунок 2.Топографические особенности кровоснабжения височной мышцы |
Качество пластической реконструкции век оценивали: по результатам функциональной активности и структуре века; наличию лагофтальма; заворота и выворота; ретракции века; а также рубцовых деформаций и гипертрофии тканей. Показателями эффективности пластической хирургии орбиты после экзентерации явились: возможность косметического протезирования, положение протеза, степень зияния глазной щели. Срок динамического наблюдения за пациентами после пластической реконструкции века и орбиты составлял 3 года и более.
На рисунке 4 и 5 (см. "Клинический пример 1" ниже) представлены этапы пластической реконструкции век и орбиты.
Результаты и обсуждение. Во время проведения операции осложнений не наблюдалось. Ранний послеоперационный период протекал с небольшим отеком тканей окружающих операционную зону, который исчез полностью через 3-4 дня. Геморрагических осложнений, расхождения краев ран и краевого некролиза пересаженных трансплантатов, при пластической хирургии обширных дефектов век и орбиты после ее экзентерации не наблюдалось. К 10-14 суткам послеоперационного периода при пластической хирургии дефектов век у всех пациентов произошло полное приживление фасциально-мышечного лоскута и прилегающих к нему слизистых и конъюнктивальных трансплантатов, восстановление нормальной топографической анатомии век. В условиях сложного рельефа век и окружающих зон лица с помощью мышечного лоскута с виска представилось возможным избежать деформаций и надежно адаптировать кожные и слизистые трансплантаты по краям раны и между собой. Удалось обеспечить лучшее питание кожных и слизистых лоскутов и сохранить анатомически правильное положение век на весь период заживления. Исключалось формирование гипертрофических рубцов и контрактур, вторичной рубцовой деформации послеоперационной зоны требующих повторных корректирующих операций. Ни в одном случае не зарегистрировано признаков послеоперационного инфицирования и некроза тканей.
В раннем послеоперационном периоде до 14 дней, после пластики экзентерированной орбиты мышечным лоскутом с виска, ни в одном случае не отмечалось расхождения швов и гнойно-воспалительных и некротических процессов. Сформированная полость была достаточная по объему для проведения косметического протезирования.
При сроках наблюдения 2-3 месяца после операции, в 1 случае отмечался частичный некроз мышечного лоскута с формированием дефекта задней стенки сформированной орбиты. Данный дефект со временем самостоятельно закрылся за счет собственных грануляций. У остальных пациентов отмечали полное приживление мышечного лоскута.
В отдаленном послеоперационном периоде (1-6 месяцев), у 3 человек диагностировано умеренное слезостояние и эпифора, вследствие рубцовой атрезии нижних слезной точки и слезного канальца, что потребовало их устранения с помощью дополнительной хирургической коррекции. У 2 пациентов отмечался небольшой рубцовый выворот нижнего века, нормальное положение которого было восстановлено после физиотерапевтического лечения в течение 2 последующих месяцев. У остальных 7 пациентов был достигнут достаточно хороший анатомический результат.
У всех прооперированных пациентов к 3-4 месяцу после операции постепенно восстановилась подвижность век, а через 1 год после операции диагностировалось их правильное положение с шириной глазной щели 8-10 мм, равной здоровому глазу. Характерным к этому периоду послеоперационного наблюдения явилось наличие гладкой поверхности слизистых и полное смыкание век, что необходимо для предотвращения развития экспозиционной кератопатии.
При сроках наблюдения 6-12 месяцев в одном случае отмечалось формирования рубцового заворота нижнего века, коррекция которого была достигнута с помощью положительного хирургического вмешательства, у 2 пациентов отмечалось частичное западение протеза (до 2-3 мм), еще у 1 пациента наблюдали сокращение полости, но с сохранением ее объема, достаточного для постоянного глазного протезирования.
Выводы.
- Использование мышечного лоскута с виска, как при пластике обширных дефектов век, так и экзентерации орбиты, способствует хорошему приживлению кожных трансплантатов и получению полноценного косметического результата.
- Применение ротированного субкутанного мышечного лоскута с виска на ножке позволяет исключить риск некротического разрушения и сокращения трансплантата из-за наличия в нем двух источников кровоснабжения (поверхностная и глубокая височная артерия), обеспечивающих питание не только его, но и поверхностного кожного и заднего слизистого лоскутов.
- Мышечный височный лоскут является универсальным пластическим материалом при обширных деформациях век и экзентерации орбиты, обеспечивает хороший функциональный и косметический результат реабилитации пациентов и низкий уровень осложнений.
- Применение мышечного лоскута с виска исключает необходимость повторных сложных реконструкций век и орбиты и расширяет возможности офтальмопластики без грубых послеоперационных повреждений.
Клинический пример №1.
Пациент К., 30 лет, диагноз – термический ожог век III-IV степени, рубцовый выворот, колобома верхнего века, выворот нижнего века правого глаза, рубцовый выворот век, мадароз левого глаза (рис. 3). Этапы операции по реконструкции верхнего века правого глаза показаны на рис. 4.
| Рисунок 3. Пациент К. до операции. |
| Рисунок 4. Этапы операции по реконструкции верхнего века правого глаза: а – формирование височного мышечного лоскута; б – ротирование лоскута в зону дефекта; в – фиксация мышечного лоскута в зону дефекта; г – пластика свободным кожным лоскутом; д – через 1 год после операции; е – восстановлена анатомия верхнего века правого глаза. |
Клинический пример №2.
Пациент Г., 40 лет, диагноз – меланома хориоидеи T4N0M0 транссклеральный рост правого глаза. Проведена экзентерация правой орбиты с сохранением только кожно-мышечного слоя век (рис. 5).
Рисунок 5. Этапы операции по экзентерации орбиты с сохранением только кожно-мышечного слоя век: а – экзентерация орбиты, тампонадой полости гемостатической губкой; б – формирование и ротирование височного лоскута; в – формирование задней стенки орбиты; г – через 3 месяца после операции. |
|
Рис. 6. Результат протезирования через 6 месяцев. |
Литература.
- Андрезен Э.Э., Лебединская Д.А., Ривкина Е.О. Профилактика сращений после ожогов глазного яблока и век // Вестник офтальмологии. – 1956. – №3. – С. 22-26.
- Белов А.И., Винокуров А.Г. Применение височной мышцы для закрытия послеоперационных дефектов // Вопросы нейрохирургии им Н.Н. Бурденко. – 1998. – №4. – C.51-54.
- Бирич Т.В. Ожоги глаз. – Минск, 1979. – С. 127-133.
- Глазные болезни / Под ред. В.Г. Копаевой. – М.: Медицина, 2002. – 560 с.
- Груша Я.О., Исмайлова Д.С., Ризопулу Э.Ф. Пластика дефектов после резекции век при доброкачественных и злокачественных новообразованиях // Вестник офтальмологии. – 2013. – №2. – С. 46-51.
- Гундорова Р.А. Тактика хирургического лечения больных с послеожоговыми изменениями век, конъюнктивы и роговицы // Вестник Офтальмологии. – 1987. – Т. 103, №5. – С. 14-17.
- Журавель В.Г. К вопросу о лечении больных базальноклеточным и плоскоклеточным раком кожи // Рос. журн. кожных и венерических болезней. – 1999. – №3. – С.4-7.
- Краснов М.Л., Беляев В.С. Руководство по глазной хирургии. – М.: Медицина, 1988. – 624 с.
- Лантух В.В., Лантух Е.В. Способ формирования нижнего свода конъюнктивальной полости // Патент №2161469 от 10.01.2001.
- Лихванцева В.Г., Анурова О.А. Опухоли век: клиника, диагностика, лечение. – М.: ГЭОТАР, 2007. – 438 с.
- Малаховская В.И. Реабилитация пациентов с дефектом средней зоны лица: Дис. … д-ра мед. наук. – М.,1997. – 303 с.
- Мухаммед Ж.Т.Р. Хирургическое лечение симблефарона с применением биоматериалов «Аллоплант»: Автореф. дис. … канд. мед. наук. – Уфа, 2005. – 24 с.
- Никитин А.А., Косяков М.Н., Спиридонова Н.3. и др. Лечение первичных и рецидивирующих базалиом мягких и костных тканей головы и шеи // Военно-медицинский журнал. – 2007. – №5. – С. 36-41.
- Филатова И.А. Анофтальм. Патология и лечение. – М., 2007. – 214 с.
- Collin J.R.O. A manual of systematic eyelid surgery (3rd ed.). – NY: Batterworth Heinemann, 2006. – 264 p.
- Johnson T.M., Ratner D., Nelson B.R. Soft tissue reconstruction with skin grafting // J Am Acad Dermatology. – 1992. – №27. – P. 151-165.
к содержанию опубликовать статью
ОРГАНИЗАЦИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ КАК ПРИМЕР ВАРИАТИВНОГО МЕТОДА В ЭСТЕТИЧЕСКОЙ БЛЕФАРОПЛАСТИКЕ
Н.А. Арефьева, С.А. Волков, А.Л. Зайцев, С.В. Иванов,
Е.А. Ляпин, М.А. Чубаков
Республиканская офтальмологическая клиническая больница, г. Ижевск
В настоящее время наблюдается устойчивая тенденция увеличения числа онкозаболеваний, в том числе придатков глаза. Опухоли век чаще располагаются в пределах кожно-мышечной пластинки, в запущенных случаях прорастают в подкожную клетчатку, хрящ века, конъюнктиву, захватывают смежные с орбитой области. Все это создает немалые трудности для хирурга, как при удалении опухоли, так и при замещении дефектов век различной протяженности и глубины.
Цель работы: выявить наиболее эффективные методы первичной блефаропластики при обширных дефектах после удаления новообразований век с учётом конечного косметического результата.
Материалы и методы.
Классификация окулопластических операций:
- блефаропластика (косметическая, заворота, выворота, деформации и смещения век),
- пластика дефектов век после иссечения опухолей и устранения последствий травм,
- пластические операции при птозе, лагофтальме и экзофтальме,
- пластика конъюнктивальной полости и дефектов глазницы (В.В. Лантух, 2010).
В период за 2012 – 2014 годы в нашей клинике прооперировано 49 пациентов, которым требовалась блефаропластика. В зависимости от стадии опухолевого процесса нами применялись следующие методы замещения дефектов век:
1. Пластика лоскутом кожи на одной или двух ножках;
2. Пластика свободным кожным лоскутом;
3. Модифицированные методы пластики свободным лоскутом с плеча путем создания дубликатуры кожного лоскута.
Размеры опухоли варьировали от 10 до 60 мм в диаметре, в том числе с прорастанием за пределы глазничной области. Возраст больных колебался от 25 до 83 лет.
По локализации опухоль чаще располагалась на коже нижнего века, рёберном крае, внутреннем углу век в проекции внутренней спайки с переходом на кожу спинки носа.
По данным гистологических исследований среди новообразований век преобладали базалиомы (до 85 % случаев), плоскоклеточный рак (10 %), внутридермальный невус (4,5%), другие (0,5%).
Результаты. Дефекты до 1см в диаметре замещались в основном пластикой местными тканями. При частичном или сквозном дефекте более 1 см, методом выбора являлась пластика на одной или двух питающих ножках, что при последнем варианте обеспечивало надёжное питание пересаженного лоскута, дающее гарантированное его приживление, лучший косметический эффект. Через одну неделю после первого этапа, при достаточном приживлении пересаженного лоскута, проводился второй этап пластики – отсечение питающих ножек, формирование века, коррекция глазной щели.
Пластика свободным кожным лоскутом традиционно применялась при больших дефектах век, образовавшихся в результате удаления обширных опухолей от 20 до 60 мм и более с распространением процесса на смежные области.
В предлагаемой модификации кожный лоскут, выкроенный с внутренней поверхности плеча, размерами в 1,5 раза превышающий по длине величину дефекта, укладывался и подшивался к краям кожной раны. Свободный конец лоскута по верхней границе формируемого века перегибался и в виде дубликатуры подшивался к конъюнктиве века изнутри.
Выводы: таким образом, выбор адекватного способа пластики в зависимости от величины дефекта после удаления опухолей век позволяет добиться хорошего функционального и косметического эффекта.
к содержанию опубликовать статью
ТАКТИЧЕСКИЕ ПОДХОДЫ К ЛЕЧЕНИЮ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ В СОЧЕТАНИИ С ОСЛОЖНЕННОЙ МИОПИЕЙ
Борзунов О.И., Коротких С.А.
ГБОУ ВПО Уральский государственный медицинский университет Минздрава России. Кафедра офтальмологии. г. Екатеринбург
Первичная открытоугольная глаукома (ПОУГ) и осложненная миопия (ОМ) на протяжении последних являются ведущими причинами слепоты и слабовидения. Осложненная миопия встречается в общей структуре близорукости с частотой до 9% [1] В тоже время, особый интерес представляет сочетанное течение двух представленных патологий в одном. По данным различных авторов, развитие ПОУГ на глазу с миопией II-III степени варьирует в диапазоне от 6 до 25% среди всех пациентов, страдающих глаукомой [2]. При сочетании ПОУГ и ОМ прогрессирование патологических процессов обусловлено схожими звеньями патогенеза, включающими гемодинамические, гидродинамические и анатомо–топографические изменения в глазном яблоке [3,4]. Учитывая общие элементы патогенеза, а так же дистрофических характер обоих заболеваний вызывают интерес с точки зрения комбинированного патогенетического лечения.
Цель
Оценить эффективность лечения пациентов, страдающих первичной открытоугольной глаукомой в сочетании с миопией
Материал и методы.
Исследование выполнено на базе клиники офтальмологии ГБОУ ВПО УГМУ. Под нашим наблюдением находилось 45 пациентов. Критериями включения являлись: открытоугольная глаукома II-III стадий, как впервые выявленная, так и на фоне местного гипотензивного лечения в сочетании с осевой миопией: объективная рефракция в условиях циклоплегии больше «-3,25», ПЗО ≥25 мм, наличие периферической хориоретинальной дегенерации сетчатки. Были установлены следующие критерии исключения: Наличие открытоугольной глаукомы I и IV стадий, смешанной и закрытоугольной глаукомы, возрастной макулярной дегенерации, миопии I степени, гиперметропии выраженных помутнений оптических сред, диабетической ретинопатии, атрофии зрительного нерва, амблиопии, а так же наличие в анамнезе хирургических и лазерных вмешательств на исследуемых глазах в течение последних шести месяцев. Всем пациентам была проведена периферическая профилактическая лазеркоагуляция сетчатки требуемого объема в целях отграничения хориоретинальных очагов. Обязательным условием начала нейропротекторной терапии являлась стабилизация внутриглазного давления. Помимо стандартного офтальмологического обследования, всем пациентам проводилась ОКТ для подтверждения диагноза и уточнения степени потери слоя нервных волокон сетчатки (СНВС), а так же параметров экскавации. Консервативное лечение заключалось в назначении местного гипотензивного лечения препаратами группы «аналоги простогландинов», электрической симпатокоррекции (№ 7-10), курса внутримышечных инъекций препарата из группы «пептидные биорегуляторы» (№ 10) с последующим назначением приема препарата, содержащего фиксированную комбинацию лютеина и зеаксантина (2 раза в день – 3 месяца).
Результаты.
У всех пациентов, прошедших лечение в сроки три и шесть месяцев, наблюдалась стабилизация основных офтальмологических параметров. Не отмечалось достоверное прогрессирование экскавации и потери СНВС. В сроки 3 месяца было зафиксировано достоверное улучшение таких показателей, как острота зрения (+11,2%), периметрические индексы MD (9,3%) и КЧСМ (+ 15,6%) по сравнению с данными до лечения. Ни у одного пациента, включенного в данное исследование, перенесшего периферическую профилактическую лазерную коагуляцию сетчатки, не отмечалось таких осложнений как разрыв и отслойка сетчатки.
Выводы.
- Методика комплексного лечения пациентов, страдающих первичной открытоугольной глаукомой в сочетании с осложненной миопией, показала эффективность в качестве патогенетически направленной антидистрофической терапии.
- Симпатокоррекция улучшает кровоток в заднем отрезке глаза, тем самым снижая эффект реперфузии, воздействуя на сосудистый компонент патогенеза и улучшая доставку пептидного биорегулятора к тканям – мишеням.
Список литературы:
- Кишкина, В. Я., Состояние микроциркуляции переднего сегмента миопических глаз / В. Я. Кишкина, Н. Т. Тимошкина, Б. Э. Малюгин // Офтальмохирургия. 1998. - № 2. - С. 47-51.
- В.П. Еричев, О.М. Филиппова Особенности рефракции у пациентов с сочетанной патологией: глаукома, катаракта и миопия //Клиническая офтальмология. Т.4. - №2. – 2003. – С. 42-44
- Иомдина, Е. Н. Биомеханика склеральной оболочки глаза при миопии: диагностика нарушений и их экспериментальная коррекция : автореф. дис. . докт. биол. наук / Е. Н. Иомдина. М., 2000. - 48 с.
- Левченко О.Г. К вопросу о роли дренажной системы глаза в прогрессировании близорукости // Вестн. офтальмол. 1988. № 6. С. 34–36.
к содержанию опубликовать статью
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В СОСУДИСТОМ РУСЛЕ ГЛАЗА ПРИ ЭКСПЕРИМЕНТАЛЬНЫХ НАРУШЕНИЯХ КРОВООБРАЩЕНИЯ
В.Н.Канюков (1), С.В. Чемезов (2), Д.А. Илюхин (1), А.В. Пряхин (3)
1 - ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, Оренбургский филиал
2 - ГБОУ ВПО ОрГМУ МЗ РФ, г. Оренбург, Россия 3 UDOM, Dodoma, Tanzania
Патология сосудистого русла глаза относится к одной из актуальных проблем в области офтальмологии. Нарушение кровообращения органа зрения нередко является причиной слепоты или слабовидения. Выявление признаков этой патологии позволяет своевременно провести профилактические и лечебные мероприятия. Как известно, кровообращение глаза обладает важной для органа зрения функцией: трофической - обеспечивающей наряду с питанием рецепторного аппарата глаза, также и состояние прозрачности его оптических сред. Реакция микроциркуляторного русла глаза при ряде заболеваний появляется еще в доклинический период, а в дальнейшем сопровождается патологическими изменениями, которые приводят к поражению различных отделов глазного яблока и нарушению зрительных функций. Несмотря на многочисленные исследования, в литературе недостаточно данных о состоянии кровеносного русла при различных вариантах нарушения кровоснабжения и венозного оттока, особенно в отдаленные сроки.
Цель настоящего исследования - выявление закономерностей макромикроскопической анатомии и микротопографии кровеносного русла глазного яблока при выключении его основных артериальных и венозных магистралей в эксперименте.
Материал и методы. Данные настоящего исследования получены в результате экспериментально-морфологического исследования, выполненного на 216 глазных яблок 108 подопытных животных (21 собака и 87 кроликов). Сроки наблюдения составили 1,7, 14 суток, 1, 1,5 и 3 месяца.
Экспериментальный раздел исследования включал проведение пяти серий опытов. В первой серии создавалась модель максимально полного нарушения кровоснабжения глазного яблока путем коагуляции обеих задних длинных ресничных артерий с одномоментной перевязкой глазной артерии. Во второй серии опытов создавалась модель по нарушению венозного оттока путем коагуляция четырех вортикозных вен с одномоментной перевязкой яремной вены на этой же стороне, в третьей серии осуществляли одномоментную перевязку обеих наружных, в четвертой – выполняли одностороннюю перевязку наружной яремной вены. В пятой серии (21 собака) создавали системный венозный застой лигированием передней полой вены дистальнее впадения в нее непарной вены.
Методика диатермокоагуляции вышеописанных сосудов проводилась после соответствующей премедикации внутриплевральным введением раствора рометар 2%, местной анестезии путем инстилляции раствора инокаина 0,4% в конъюнктивальную полость и ретробульбарного введения раствора новокаина 0,5% - 0,5 мл.
Выведение животных из эксперимента проводилось внутриплевральным введением летальной дозы раствора рометар 2%.
При выполнении всех серий опытов использованы следующие методы исследований: биомикроскопия в диффузном освещении с фотографированием, макромикроскопическое препарирование, гистотопографический метод с окраской по Ван-Гизону, гематоксилином и эозином, морфометрия под МБС-10 с помощью окуляра-микрометра при увеличении 16-56 крат.
Все полученные морфометрические показатели были подвергнуты вариационно-статистической обработке.
Результаты. Наиболее распространенными и постоянно обнаруживаемыми морфологическими изменениямипри нарушениях венозного оттока в глазном яблоке и ретробульбарных образованиях были полнокровие венозных сосудов и микроциркуляторного русла, стаз, диапедезные кровоизлияния. В тяжелых случаях в процесс вовлекались и артериальные сосуды.
Наиболее выраженные изменения обнаружены в собственно сосудистой оболочке (хориоидее). В переднем отделе сосудистой оболочки глаза – цилиарном теле, цилиарных отростках и радужке, а также в склере они отмечались значительно реже.
Наряду с общими для всех исследованных образований признаками нарушения венозного оттока в некоторых из них были обнаружены особенности. Так, в хориоидее особенностью проявления венозного застоя являлось образование внутрисосудистых эритроцитарных конгломератов (явления сладжирования). Они имели различную форму и величину – от мелких неправильной формы до относительно более крупных, вытянутых по длиннику сосуда.
Кровоизлияния в заднем отделе сосудистой оболочки глаза имели плоскую форму, располагаясь, в основном, в местах слияния венозных сосудов. Такими местами в хориоидее являлись зоны формирования вортикозных вен и участок, соответствующий заднему полюсу глаза. Здесь же отмечено наиболее выраженное полнокровие сосудов.
Среди ретробульбарных образований наиболее резкие и выраженные морфологические изменения при системном венозном застое обнаружены в ретробульбарной клетчатке. Здесь хорошо прослеживалось полнокровие всех отделов сосудистого русла – вен, капилляров, артерий. Кровоизлияния имели четкую связь с рядом расположенными сосудами. По своим размерам они относились как к мелким, диапедезным, так и к крупным - сливным, занимающими большие участки и окружающими расположенные рядом кровеносные сосуды и нервы.
В мышцах глазного яблока особенностью морфологического проявления венозного застоя была небольшая распространенность кровоизлияний, которые располагались лишь по ходу сосудов, но не распространялись вширь.
Особенности морфологии нарушения венозного оттока в зрительном нерве заключались в развитии межуточного отека нервной ткани, сопровождающегося уменьшением межвлагалищного пространства, и в появлении межоболочечных диапедезных кровоизлияний, тогда как кровоизлияний в ткани самого нерва не было выявлено.
Обнаруженные при биомикроскопии изменения со стороны сосудов бульбарной конъюнктивы подразделялись на внутрисосудистые и внесосудистые. К первым относятся: прерывистость и замедление кровотока, сладж, стаз, полнокровие; ко вторым – изменения калибров, увеличение извитости, варикозоподобные и аневризматические изменения сосудов. Сводные данные об изменениях в сосудистом русле бульбарной конъюнктивы при экспериментальном венозном застое представлены в таблице.
При нарушении венозного оттока из глазницы в первые минуты появлялись внутрисосудистые изменения, затем - изменения со стороны сосудистой стенки.
Обнаружены перистальтические сокращения сосудистой стенки вен. Они появлялись в течение 30-60 минут после лигирования обеих наружных яремных вен. В микроциркуляторном русле кровоток проявлялся в виде «четок».
К концу острого периода обнаруживалось увеличение плотности сосудистой сети за счет увеличения количества коллатералей и анастомозов между сосудами, а также увеличения диаметров межсосудистых анастомозов.
Части сосудистого русла |
Острый период |
Отдаленный период |
Вены и венулы |
|
|
Пост- |
|
|
Капилляры |
|
|
Артериолы |
|
|
В период наблюдения 2-х недели и более отмечена положительная динамика в виде частичной нормализации кровотока и конфигурации сосудистой сети. Однако в процессе всего срока наблюдения (до 1 месяца) полной нормализации сосудистого русла конъюнктивы так и не произошло.
Гистологическое исследование бульбарной конъюнктивы полностью подтвердило данные, полученные при ее биомикроскопии.
При нарушении артериального кровоснабжения в конце первых суток биомикроскопически отмечалось резкое расширение сосудов области лимба. На вторые сутки после операции сосуды приобретали неравномерный калибр, появлялась сеть капилляров, которые в ряде случаев стали образовывать петли, пронизывающих роговицу - зона активного роста. На третьи сутки хорошо определялись сосуды роговицы в виде алой каймы, шириной 1,0-1,2 мм. Зона роста была представлена либо в виде сильно переплетающихся между собой капилляров, либо идущих параллельно друг другу. Этот факт свидетельствовал о разной глубине залегания новообразованных сосудов. Прогрессирование роста сосудов роговицы отмечалось до 7-8 суток. В отдаленных сроках (1 и 3 месяца) после операции выявлено замедление роста сосудов роговицы с постепенным увеличением диаметра из просвета. Становилась более выраженной артериовенозная петля, обращенная к центру роговицы.
Начиная со второй недели, достаточно выраженные деструктивные преобразования гемоциркуляторного русла охватывали всю толщу радужной оболочки. Наблюдались участки с редкой сосудистой сетью в значительной степени лишенной капиллярного компонента, исчезал рисунок сосудистых петель в области зрачкового края радужки. Изменения состояния большого артериального круга радужки (БАК) также подвергались грубым изменениям. Так, уже на 4 сутки после прекращения кровотока в глазном яблоке подопытного животного диаметр БАК составил 212,2 мкм (261,9%). Минимальное значение данного параметра составило 57,2 мкм (70,6%). В ряде случаев из-за выраженных атрофических изменений ни БАК, ни радиальных артерий нам определить не удалось.
Деструкция носила характер атрофии сосудистого русла как радужной оболочки, так и ресничных отростков цилиарного тела, изменяющих свою конфигурацию и величину. С конца второй недели капиллярное русло ресничных отростков исчезало, сосуды становились грубыми, а сами отростки сливались в конгломераты. В отдаленные сроки в результате полной атрофии они не дифференцировались. В случаях сохраненной в той или иной степени структуры ресничных отростков их толщина изменялась от 28,0 до 105,9 мкм. Расстояние между отростками колебалось в пределах от 0 до 243,1 мкм, в то время как нормальные показатели данного параметра составили в среднем 397,6 мкм.
Сосудистое русло ресничного тела глаза кролика, представленное в основном венозными сосудами, также подвергалось грубым изменениям в условиях нарушенного кровоснабжения. Максимальный диаметр просвета вены ресничного тела составил 168,0 мкм и соответствовал сроку 4 дня после операции. Минимальный размер данного параметра был обнаружен в сроке 3 месяца и составил 28,6 мкм.
В зависимости от длительности периода от момента операции по нарушению кровоснабжения и до выведения животного из эксперимента наблюдалась субатрофия глазного яблока, проявляющаяся уменьшением его величины. Так, в сроке 4 дня длина глаза кролика уменьшилась до 15,1 мм (89,3% от размера интактного глаза), тогда как через 3 месяца из-за грубой атрофии глазного яблока переднезадний размер составил 7,1 мм (39,9%).
Выводы.
Для нарушений артериального кровоснабжения и венозного застоя в переднем отделе глазного яблока характерна стадийность анатомических изменений.
Полное нарушение артериального кровоснабжения переднего отдела глаза приводит к последовательным макромикроскопическим изменениям, состоящим в сужении сосудов конъюнктивы и образовании аваскулярных зон с последующим компенсаторным расширением сосудов, интенсивной васкуляризации и помутнением роговицы к концу первой недели, субатрофическим изменениям ресничных отростков в виде соединительнотканного перерождения и распространением субатрофии на все глазное яблоко.
Для венозного застоя в переднем отделе глаза характерны: резкое расширение сосудов конъюнктивы в первые сутки, разнообразные по морфологии венозные кровоизлияния в переднюю камеру глаза, радужку и ресничные отростки, васкуляризация роговицы, субатрофические изменения ресничных отростков, распространение субатрофии на все глазное яблоко.
Приведенные данные позволяют выявить ранние и отдаленные диагностические признаки микроциркуляторных изменений сосудистого русла глаза не только с целью оценки тяжести патологических процессов, но и с целью предупреждения вторичных осложнений.
Литература
- Бунин А. Я., Кацнельсон Л. А., Яковлев А. А. Микроциркуляция глаза // М.: Медицина, 1984. – 176 с.
- Волошинов Д. Б. Особенности строения сосудистой оболочки глаза кролика и возможность создания в ней коллатерального кровообращения // Вопр. сосуд. патол. органа зрения. – Харьков, 1972. – С. 182-184.
- Корниловский И., М. Сычев Г. М и др. Создание коллатерального кровообращения в оболочках переднего отдела глаза // Вопр. клин. офтальмол. и глазн. травматизма. – Красноярск, 1974. – С. 158-168.
- Куприянов В. В., Караганов Я. Л. и др. Микроциркуляторное русло // М. Медицина, 1975. – 216 с.
- Лычковский Л. М. Венозное русло глазного яблока кролика в условиях окольного кровообращения // Арх. анат. – 1965. - №3. – С. 50-55.
- Лычковский Л. М. Ранние сроки развития коллатерального артериального кровообращения в глазном яблоке // Арх. анат. – 1968. - №4. – С. 36-42.
- Пряхин А. В. Различия макромикроскопического строения и микротопографии источников кровоснабжения и кровеносного русла переднего отдела глаза кролика в норме и при нарушении кровоснабжения // Известия Оренб. гос. аграрн. унив. – Оренбург, 2008. – С. 154-156.
- Судакевич Д. И. Архитектоника системы внутриглазного кровоснабжения и ее нарушения. - М.: Медицина, 1971. – 112 с.
- Чемезов С. В. Морфофункциональные данные о состоянии сосудистого русла глаза при нарушениях венозной гемодинамики в эксперименте // Физиол. и патол. механиз. адаптац. орг. зрения. – Владивосток, 1983. – Т. 2. – С. 175-177.
- Чемезов С.В. Состояние кровеносного русла сосудистой оболочки глазного яблока и ретробульбарных образований при венозном застое в эксперименте // Арх. анатомии, гистологии и эмбриологии. - 1984. - Т.87, N10. - С.47-54.
- Чемезов С.В. Сосудистые изменения в глазном яблоке и ретробульбарных образованиях глазницы при системном венозном застое. - Автореф. дисс. … канд. мед. наук. - М.,1984. - 16 с.
- Barany E. H. Influence of local arterial blood pressure on aqueous humour and intraocular pressure // Acuta ophthtalm. – 1947. Vol. 25. – P. 81-94.
- Heymann V., George J. L., Sirbat D., Rauber G., Raspiller A. Arterial supply to the anterior segment of the eye. Radioanatomical study of a series of 25 human eyes // J. Fr. Ophtalmol. - 1985. - V. 8. - №11. - Р. 697-703.
- Langha M. E. Influence of the intraocular pressure on the formation of the aqueous humor and the outflow resistance in the living eye // Brit. J. Ophthalm. – 1959. – Vol. 43. – P. 705-732.
- Reitsamer H. A. A rabbit model to study orbital venous pressure, intraocular pressure and ocular hemodynamics simultaneously // Invest Ophthalmol Vis Sci. – 2002. – Vol. 43(12). – P. 3728-3734.
- Steuhl K. P., Rohrbach J. M., Diener H. C. Eye changes in stenoses of the internal carotid artery histologic and clinical findings // Klin. Monatsbl. Augenheilkd. - 1986. – V. 189. - №4. – Р. 302-307.
- Tawara A., Kubota T., Hata Y. et al. Neovascularization in the anterior segment of the rabbit eye by experimental anterior ischemia // Graefes Arch. Clin. Exp. Ophthalmol. – 2002. – V. 240. - №2. – Р. 144-1453.
- Virdi P. S, Hayreh S. S. Anterior segment ischemia after recession of various recti. An experimental study // Ophthalmology. – 1987. – V. 94. - №10. – Р. 1258-1271.
к содержанию опубликовать статью
НОВЫЕ ХИРУРГИЧЕСКИЕ ВОЗМОЖНОСТИ ЛЕЧЕНИЯ СОСУДИСТОЙ И ВОСПАЛИТЕЛЬНОЙ ПАТОЛОГИИ ГЛАЗА
Данилова Л.П.врач-офтальмолог, заведующий отделением комплексно-реабилитационного лечения Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России, ассистент кафедры офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края (1,2), Егоров В.В.д.м.н., профессор, директор Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России, заведующий кафедрой офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края (1,2), Смолякова Г.П. доктор медицинских наук, профессор, врач-офтальмолог клинико-экспертного отдела Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России, профессор кафедры офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края (1,2), Еманова Л.П.врач-офтальмолог отделения комплексно-реабилитационного лечения Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России (1), Поваляева Д.А.врач-офтальмолог отделения комплексно-реабилитационного лечения Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России (1)
1 - Хабаровский филиал ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России
2 - КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края
Проведен анализ усовершенствованного способа хирургической офтальмолимфодетоксикации и его эффективность при лечении пациентов с сосудистыми и воспалительными заболеваниями глаза. Сроки клинического выздоровления больных в среднем были сокращены на 30%, а достигнутая острота зрения при выписке из стационара превышала исходный уровень в 3,2 раза.
Ключевые слова: : офтальмолимфодетоксикация, сосудистые и воспалительные заболевания глаз
Key words: ophthalmolymphodetoxication, vascular and inflammatory eye diseases
Актуальность. Хронические увеиты, сосудистые заболевания глаз, внутриглазные кровоизлияния и их последствия остаются в числе главных причин слепоты и слабовидения [1]. При этих патологических состояниях внутри глаза накапливаются токсические метаболиты, что сопровождается развитием офтальмоэндотоксикоза, поддерживающего воспалительный процесс и провоцирующего развитие макулярного отека, возникновение пролиферативных реакций с необратимыми структурными и функциональными повреждениями зрительно-нервного аппарата [2].
Поэтому важным патогенетическим звеном в лечении данной тяжелой патологии является выведение токсических метаболитов из полости глаза, путем оптимизации гуморального транспорта в тканевом звене, лимфатического дренажа и функций лимфатической системы [3,4].
Существуют различные способы уменьшения эндотоксикоза воздействием на лимфатическую систему различных лекарственных препаратов. Так, экстракорпоральные методы осуществляются путем выполнения лимфостимулирующих, лимфотропных крылонёбных и околоушных блокад, лечебный эффект которых достигается за счет топографии выполнения и рецептуры блокад [5].
В клинической медицине для уменьшения явлений эндотоксикоза используют методы эфферентной патогенетической терапии – плазмоферез, гемосорбция и т.д. [6].
Однако лечебный эффект лимфатического дренажа при введении лекарственных препаратов в дистантные лимфокорректоры ограничивают автономность органа зрения и его барьерную изолированность. Экстракорпоральная терапия имеет большое количество противопоказаний к проведению, не исключает риск возникновения осложнений и для ее выполнения требуется специальное оборудование, помещение и подготовленный медицинский персонал.
Лимфосорбционные технологии в офтальмологии являются новым способом элиминации продуктов распада форменных элементов крови при гемофтальмах, кровоизлияниях на глазном дне, токсических метаболитов и экссудата при внутриглазном воспалении.
С этой целью в ФГБУ «Всероссийский центр глазной и пластической хирургии» Минздрава России (г. Уфа, 2004) разработана и внедрена в клиническую офтальмологию лимфодренирующая операция с использованием специального биоматериала Аллоплант для аутолимфосорбции при его супрахориоидальной имплантации [7].
Однако возможность активного выведения токсических метаболитов из полости глаза при данном методе ограничивает теноновая фасция, не имеющая лимфатических сосудов. Вместе с тем развитие слипчивого воспаления и быстрая рубцовая блокада вновь созданной в глазу биологической системы лимфодренажа ограничивает лечебные возможности данной операции и задерживает наступление клинического выздоровления [8].
Целью работы явилось изучение преимуществ усовершенствованного способа хирургической офтальмолимфодетоксикации и его эффективность при лечении пациентов с сосудистыми и воспалительными заболеваниями глаза.
Материал и методы. В основе предложенной нами офтальмолимфодетоксикации лежит технология аутолимфосорбции с введением Аллопланта в супрахориоидальное пространство. Лечебный механизм нашего способа включал дополнительный этап – иссечение в зоне операции участка теноновой фасции, размером 8-10мм у основания, длиной 10мм. Это позволило создать непосредственный контакт дренирующего биоматериала с лимфатической системой бульбарной конъюнктивы глаза, тем самым оптимизировать условия функционирования лимфодренажа, уменьшить степень воспалительной реакции и адгезивных процессов с развитием фиброза [9].
Клиническая эффективность данного способа была прослежена при динамическом наблюдении 53 больных (53 глаза). Возраст пациентов варьировал от 45 до 65 лет (в среднем 58±3,2 года). Среди них мужчин было 21, женщин – 32. Из всей совокупности пациентов 19 человек (19 глаз) имели частичный и субтотальный гемофтальм сосудистого происхождения, у 34 человек (34 глаза) наблюдался хронический рецидивирующий увеит.
Результаты лечения оценивали по данным визометрии с максимальной коррекцией, оптической когерентной томографии (ОКТ) макулярной зоны («Stratus», фирма «Zeiss-Meditec» (Германия), программа Retinal Map), офтальмоскопии макулярной зоны (бесконтактная линза 90 Дптр), флуоресцентной ангиографии глазного дна (цифровая фундус-камера «Visucal Lite» фирмы «Zeiss-Meditec», Германия).
С помощью В-сканирования оценивали акустическую плотность помутнений стекловидного тела в динамике (В-скан фирмы «АVISO», разрешающая способность 0,1мм). Всем пациентам проводилась также тонометрия, биомикроскопия.
Мониторинг исследования выполнялся до лечения, через 7-10 дней после операции и через 3 месяца от начала лечения.
Критериями эффективности результатов проводимого лечения явились: толщина и объем макулярной сетчатки по данным ОКТ, острота зрения вдаль с максимальной коррекцией, показатели В-сканирования стекловидного тела, офтальмоскопическая картина глазного дна.
Результаты. У всех 19 больных с гемофтальмом анализ В-сканограмм к 7-10 дню наблюдения показал, что при лечении данным способом достоверно уменьшился объем крови и сгустков в стекловидном теле. При этом средний биомикроскопический индекс гемофтальма ко дню выписки уменьшился с 9,0±2,1 до 6,0±1,8, к 1-месяцу до 1,4±0,88. Острота зрения к этому сроку наблюдения соответственно возросла до 0,35±0,11 против 0,17±0,05 исходно. К 3 месяцам в 76,6 % случаев наступило полное рассасывание гемофтальма и повышение остроты зрения в среднем до 0,71±0,15.
Исходно, у всех 34 пациентов с хроническими увеитами острота зрения была снижена до 0,09-0,4 (в среднем 0,25±0,15), ВГД в пределах 19-22 мм рт.ст. Из них у 19 человек развился макулярный отек, вследствие нарушения гемоофтальмического барьера и скопления транссудативной жидкости в слоях сетчатки. При этом офтальмоскопически отсутствовал фовеолярный и макулярный рефлексы, визуализировались ретинальные воспалительные инфильтраты. Диск зрительного нерва (ДЗН) был отечен, контуры его стушеваны, вены сетчатки неравномерного калибра, полнокровные, извиты. По сосудистым аркадам наблюдался паравазальный отек.
К началу наблюдения, по данным ОКТ у этих пациентов зарегистрировано диффузное увеличение толщины сетчатки в макуле (в среднем 525,7±7,3мкм). Объем макулы составил 13,7±0,25 мм3. У 10 пациентов в области макулы на фоне утолщения сетчатки определялись кисты, заполненные жидкостью.
При проведении ФАГ были выявлены: гиперфлюоресценция ДЗН, расширение перифовеолярной капиллярной сети, в позднюю венозную фазу имел место выход флюоресцеина из перифовеолярных сосудов, дезорганизация пигментного эпителия сетчатки.
Показатели высоты макулярного отека (МО) сетчатки у больных исследуемой группы в различные сроки наблюдения представлены в таблице.
Таблица
Динамика средних показателей высоты отека сетчатки при лечении МО на фоне хронического увеита (мкм)
Группа исследования |
исходно |
через 1 мес. |
через 3 мес. |
19 человек |
525,7±7,3 |
424,5±11,2* |
256,3±9,2* |
Примечание: * – достоверность различий p<0,05.
Из представленной таблицы видно, что через 1 месяц после оперативного лечения у большинства пациентов отмечена значительная редукция МО. Толщина сетчатки в макуле уменьшилась до 424,5±11,2мкм. Одновременно было отмечено полное исчезновение отека ДЗН и стушеванность его контуров, частично рассосались инфильтраты на сетчатке и полосчатые кровоизлияния по сосудистым аркадам.
Через 3 месяца наблюдения у всех пациентов центральная толщина макулярной сетчатки значительно уменьшилась, составив в среднем 256,3±9,2мкм. Рецидива отека сетчатки ни в одном случае не наблюдалось. На глазном дне полностью рассосались инфильтраты и кровоизлияния, нормализовался калибр венул.
Одновременно с редукцией МО объем макулы во всех случаях также уменьшался, составив к 3 месяцам наблюдения 11,2±0,15 мм3.
Положительная динамика морфометрических показателей сетчатки, рассасывание ретинальных геморрагий и инфильтратов к 3 месяцам наблюдения сопровождались повышением остроты зрения у всех пациентов на 0,31±0,05 относительно исходного уровня, составив в среднем 0,65±0,05.
У остальных 15 человек, страдающих хроническим увеитом, исходно при офтальмоскопии в стекловидном теле визуализировался флер, воспалительная экссудация в виде клеточной взвеси + или ++. По данным В-сканирования у 5 человек определялся конгломерат плавающих помутнений, не фиксированных к сетчатке. У 3 пациентов в стекловидном теле сформировались плотные мембраны, которые привели к его задней отслойке.
К 7-10 дню после проведенного оперативного вмешательства полное купирование клинических признаков воспаления наступило у 78,4% больных, у остальных 21,6% выздоровление было констатировано к 12-15 дню. Острота зрения у всех 15 пациентов к этому периоду наблюдения повысилась до 0,74±0,15 против 0,29±0,09 исходно за счет рассасывания экссудации в стекловидном теле.
В раннем послеоперационном периоде (1-3 месяца) ни в одном случае не сформировался фиброз стекловидного тела, который мог привести к швартообразованию и развитию такого грозного осложнения, как отслойка сетчатки.
Заключение. Способ хирургической офтальмолимфодетоксикации является перспективным методом в лечении сосудистых и воспалительных заболеваний глазного яблока, а предлагаемая модификация усиливает патогенетическую направленность операции и, тем самым, способствует повышению лечебного эффекта. Сроки клинического выздоровления больных в среднем были сокращены на 30%, а достигнутая острота зрения при выписке из стационара превышала исходный уровень в 3,2 раза.
Вместе с тем, следует отметить, что предлагаемое дополнение к операции лимфосорбции не усложняет ее технику, не пролонгирует операционное время, не требует новых лекарственных затрат и не приводит к возникновению операционных и послеоперационных осложнений, кроме тех, которые описаны при выполнении базовой технологии операции.
Список литературы:
- Либман Е.С., Шахова Е.В. Слепота, слабовидение и инвалидность по зрению в Российской Федерации // Ликвидация устранимой слепоты. Всемирная инициатива ВОЗ: мат. рос. межрегион. симпозиума. – Уфа. 2003. С. 38–42.
- Панова И.Е., Дроздова Е.А. Увеиты: руководство для врачей. – М.: ООО «Издательство «Медицинское информационное агентство», 2014. – 144 с.
- Субботина И.Н. Лимфологические методы лечения в офтальмологии // Вестник офтальмологии. – 1999. – №1. – С. 36-37.
- Бородин Ю.И., Асташов В.В., Горчаков В.Н. и др. Фитоминеральные композиции для стимуляции дренажно-детоксикационной фунуции лимфатической системы. - Новосибирск: «Манускрипт», 2004. – 14 с.
- Коваленко Ю.Ф., Линник Л.Ф., Коврижных Н.А., Тюляев А.П., Оценка эффективности регионарных вегетативных блокад в офтальмохирургии // Офтальмохирургия. – 1991 – №1. – С. 49-58.
- Бородин Ю.И., Труфакин В.А., Любарский М.С. и др. Очерки по клинической лимфологии. – Новосибирск, 2001. – 191 с.
- Мулдашев Э.Р. Биоматериалы аллоплант для регенеративной хирургии (информационное письмо). – Уфа, 2004. – С. 2-8.
- Данилова Л.П., Смолякова Г.П., Швачко Н.С., Еманова Л.П. Клиническая эффективность хирургического способа офтальмолимфодетоксикации при лечении пациентов с сосудистыми и воспалительными заболеваниями глазного яблока // Доказательная медицина – основа современного здравоохранения: материалы междунар. конгр. – Хабаровск: Ред.-изд. центр ИПКСЗ, 2011. – С. 59-61.
- Пат. 2326632 РФ. Способ офтальмодетоксикации при воспалительных, сосудистых и дистрофических глазных заболеваниях / Смолякова Г.П., Данилова Л.П., Еманова Л.П. – № 2006145392/14; заявл. 21.12.2006; опубл. 20.06.2008, Бюл. №17. – 5 с.
к содержанию опубликовать статью
ИНТРАОКУЛЯРНОЕ ДАВЛЕНИЕ ПРИ ФАКОЭМУЛЬСИФИКАЦИИ КАТАРАКТЫ С ФЕМТОЛАЗЕРНЫМ СОПРОВОЖДЕНИЕМ
Е.А. Калижникова (1,2), О.И. Лебедев (2),
В.А. Жадан (1), Е.И. Трофимова (1) ,
В.Е. Зайцева (2)
1 - БУЗОО «Клиническая офтальмологическая больница им. В.П. Выходцева», г. Омск
2 - ГБОУ ВПО «Омская государственная медицинская академия Министерства здравоохранения Российской Федерации», г. Омск
врач-офтальмолог, заведующий отделением комплексно-реабилитационного лечения Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России, ассистент кафедры офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края
Операция экстракции катаракты является наиболее часто выполняемой операцией в глазной хирургии, которой ежегодно подвергаются около 19 млн. человек и только 3 млн. человек в США. К 2020 году по оценкам ВОЗ ежегодно будут оперироваться примерно 32 млн. человек во всем мире [7].
Факоэмульсификация катаракты (ФЭК) в настоящее время остается «золотым стандартом» операции экстракции катаракты. В последние годы активными темпами идет освоение использования фемтосекундного лазера для выполнения некоторых этапов операции, характеризующихся наибольшим процентом осложнений и требующих высокоточного исполнения [9].
В ходе этой операции после установки интерфейса на глазную поверхность пациента создается определенный уровень вакуума в системе. Этот процесс характеризуется увеличением внутриглазного давления (ВГД). Продолжительность «вакуумной фазы» операции и, соответственно, состояния повышенного офтальмотонуса различны.
Ключевые слова: интраокулярное давление, факоэмульсификация катаракты, фемтолазерное сопровождение
Цель: провести оценку внутриглазного давления при факоэмульсификации катаракты с фемтолазерным сопровождением.
Материалы и методы
Проанализированы все материалы, касающиеся темы исследования, опубликованные в базах данных крупнейших электронных медицинских ресурсов, русскоязычных и иностранных электронных специализированных порталах, журналах, сборниках международных конференций и конгрессов за последние годы.
Результаты и обсуждения
Фемтосекундная хирургия катаракты является развивающейся технологией, которая может потенциально привести к более качественному и надежному исходу операции [13].
Наиболее распространенными этапами ФЭК, которые в настоящее время офтальмохирурги выполняют с помощью фемтосекундного лазера, являются: корнеальный разрез, передний капсулорексис и фрагментация вещества хрусталика. Некоторые преимущества метода: лучше качество разрезов с уменьшением степени индуцированного астигматизма и более стабильной рефракцией в послеоперационном периоде, надежность выполняемой капсулотомии, снижение времени использования ультразвука [1,4].
Нужно отметить, что эти преимущества проявляют себя эпизодически, в случаях ни чем не осложненного хода операции.
На сегодняшний день нет качественного, соответствующего критериям доказательной медицины, клинического исследования, которое доказало бы абсолютное превосходство ФЭК с фемтолазерным сопровождением с точки зрения полученных результатов и безопасности по сравнению с классической техникой операции [1].
Quiñones A. с соавт., проанализировав данные клинических исследований и литературных обзоров, опубликованных в MEDLINE®, говорят об отсутствии статистически значимых различий по количеству осложнений и качеству жизни пациентов после ФЭК и фемтоФЭК. Таким образом, по данным, опубликованным в MEDLINE®, ФЭК с фемтолазерным сопровождением признана операцией эффективной и безопасной, с наличием определенных преимуществ, перед классической методикой операции [2].
Четыре доступные на сегодняшний день на рынке офтальмологического оборудования фемтоплатформы имеют различные интерфейсы. Контактные - имеют меньший диаметр и подходят для пациентов с малой переднезадней осью. Бесконтактные интерфейсы в меньшей степени вызывают подъем ВГД и развитие других осложнений [7].
Известно, что в ходе операции глаз пациента не должен совершать движений, так как, это повлечет за собой неточность выполнения корнеальных разрезов, децентрацию капсулотомии, а также, развития ряда трудностей в ходе самой операции, которые потом могут привести к нежелательным последствиям.
Повышение уровня ВГД и развитие субконъюнктивальных геморрагий также относятся в иностранной литературе к отрицательным факторам, сопровождающим фемтоФЭК. Геморрагии, в большей мере индуцированные использованием контактных интерфейсов, рассасываются в течение нескольких дней и, как правило, не требуют назначения дополнительных лекарственных препаратов.
Лазерное воздействие в ходе операции, по разным данным, может продолжаться от 30 секунд до 30 минут в зависимости от возможностей лазерной платформы и категории плотности ядра и, соответственно, повышенный офтальмотонус сохраняется на протяжении всего этого времени. Капсулорексис выполняется в первую очередь и занимает от 15 до 18,0 секунд (в зависимости от лазерной платформы), затем производится фрагментация ядра и создание роговичных разрезов. Если ход этих этапов по различным причинам нарушается, то создание капсулорексиса, роговичных разрезов и фрагментация должны быть закончены вручную [7].
Conrad-Hengerer I. с соавт. отмечают, что для фрагментации более твердых ядер может понадобиться приблизительно от 30 до 60 секунд [6].
Из других источников - среднее время использования вакуумного интерфейса в ходе фемтоФЭК составляет от 20 до 60 секунд. На протяжении этого времени ВГД достигает ориентировочно 80 мм рт. ст., что не нарушает кровоснабжение в глазу. Такое давление, например, можно получить, если пальцем надавить на глаз [8].
Caceres V. отмечает, что работа фемтолазера в ходе ФЭК занимает от 3 до 5 минут, что сопоставимо с временем, которое бы затрачивал хирург на выполнение этапов операции механически [3].
По результатам оценки изменения уровня ВГД при фемтоФЭК с использованием жидкостного интерфейса Schultz T. с соавт. отмечают, что уровень ВГД по завершении операции ненамного превышает дооперационный. Среднее ВГД до операции было 15.6±2,5 мм рт. ст. (SD), по окончании вакуумного этапа операции - 25.9±5.0 мм рт. ст. (SD), после удаления интерфейса - 19.1±4.4 мм рт. ст. (SD). Через 1 час после операции уровень ВГД не отличался от предоперационного [11].
Kerr N.M. с соавт. приводят иные данные, полученные ими в ходе исследования офтальмотонуса пациентов на этапах операции ФЭК с фемтолазерным сопровождением с использованием жидкостного интерфейса. Средний исходный уровень ВГД у пациентов в ходе их исследования составил 17,5±2,4 мм рт.ст. (SD). На вакуумном этапе применения интерфейса повышение ВГД в среднем составило 11,4±3,3 мм рт. ст. Самый высокий уровень офтальмотонуса был зафиксирован сразу после лазерной фрагментации ядра (36,0±4,4 мм рт. ст.). Среднее повышение показателей офтальмотонуса от базового уровня на протяжении всей операции составило 18,5±4,7 мм рт.ст. Уровень ВГД оставался выше базового в течение 2 минут после операции (26,6±4,0 мм рт.ст.) (р < 0,001 ) [10].
По данным Talamo J.H. с соавт. среднее ВГД в вакуумную фазу было 32,4±3,4 мм рт. ст. (SD) в группе с использованием контактного интерфейса и 17,7±2,1 мм рт. ст. в группе пациентов, которым фемтоФЭК проводилась с применением жидкостного интерфейса. Также, авторы делают акцент на том, что использование контактных интерфейсов в значительном проценте случаев приводит к развитию субконъюнктивальных геморрагий, складчатости роговицы, неполного переднего капсулорексиса, разгерметизации вакуумной системы вследствие подвижности глаза пациента [7,12].
Таким образом, в соответствии с приведенными данными, ВГД в ходе операции фемтоФЭК повышается. Наибольший уровень ВГД фиксируется по завершении вакуумного этапа операции. Показатели повышенного офтальмотонуса незначительно отличаются от исходных, дооперационных показателей, соответствующих пределам нормы. В силу того, что в среднем в неосложненных случаях продолжительность операции составляет несколько минут, то гипертонус в течение этого времени не нарушит функционирование различных глазных структур.
Заключение
Факоэмульсификация катаракты с фемтолазерным сопровождением является высокоэффективным и безопасным хирургическим методом, который выводит операцию по удалению катаракты на новый уровень.
По имеющимся данным, интраокулярное давление в ходе этой операции повышается незначительно, что не приводит к развитию неприятных последствий.
В долгосрочной перспективе фемтосекундный лазер может заменить традиционную факоэмульсификацию которая была стандартом хирургии катаракты в течение последних десятилетий. Кроме точности и предсказуемости результатов, низкая частота осложнений впечатляет хирургов, уже освоивших эту технологию [5].
Литература
- Abouzeid H. [Femtocataract surgery: a promising future?] // Rev. Med. Suisse. – 2013. – Vol. 11. – N. 9. – P. 2350-2353.
- Benefits and Harms of Femtosecond Laser Assisted Cataract Surgery: A Systematic Review [Internet] / A. Quiñones [et al] // Washington (DC): Department of Veterans Affairs; 2013.
- Caceres V. Femtosecond phaco techniques and outcomes. – Eye world - 2014.
- Dalton M. “Laser-Assisted Cataract Surgery; Bringing New Technologies Into the Fold” // EyeWorld. – 2011. - P. 30–31.
- Dick H.B., Schultz T. Femtosecond laser-assisted cataract surgery / H.B. Dick, T. Schultz // Ophthalmologe. -2014. - Jun 25.
- Effect of femtosecond laser fragmentation of the nucleus with different softening grid sizes on effective phaco time in cataract surgery / I. Conrad-Hengerer [et al] // J. Cataract Refract Surg. - 2012. – Vol. 38. – P. 1888–1894.
- Femtosecond laser–assisted cataract surgery / E. Donaldson Kendall [et al] // J. Cataract Refract. Surg.- 2013. – Vol. 39. - P. 1753–1763.
- [http://www.silmakirurgia.ee/ru].
- Hybrid phacoemulsification: a new stage in the improvement of cataract surgery (?) / S. É. Avetisov [et al] // Vestn. Oftalmol. – 2014. – Vol. 130. - N 2. – P. 4-7.
- Intraocular pressure during femtosecond laser pretreatment of cataract / N.M. Kerr [et al] // J. Cataract Refract Surg.- 2013. - Vol.39. - N3. – P. 339-342].
- Intraocular pressure variation during femtosecond laser–assisted cataract surgery using a fluid-filled interface / T. Schultz [et al] // J. Cataract Refract Surg. – 2013. – Vol. 39. – P. 22–27.
- Optical patient interface in femtosecond laser-assisted cataract surgery: contact corneal applanation versus liquid immersion / J.H. Talamo [et al] // J. Cataract Refract Surg. -2013. - Vol. 39. – N. 4. – P. 501-510.
- Uy H.S., Edwards K., Curtis N. Femtosecond phacoemulsification: the business and the medicine // Curr. Opin. Ophthalmol. – 2012. – Vol. 23. – N. 1. – P. 33-39.
к содержанию опубликовать статью
АНАТОМИЧЕСКИЕ РАЗЛИЧИЯ ДРЕНАЖНОГО АППАРАТА ГЛАЗА КАК ФАКТОР ВОЗМОЖНЫХ НАРУШЕНИЙ ОТТОКА ВОДЯНИСТОЙ ВЛАГИ
И.И. Каган, В.Н. Канюков
Кафедра оперативной хирургии и клинической анатомии им. С.С. Михайлова Оренбургского государственного медицинского университета Оренбургский филиал МНТК «Микрохирургия глаза им. акад. С.Н. Федорова»
врач-офтальмолог, заведующий отделением комплексно-реабилитационного лечения Хабаровского филиала ФГБУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России, ассистент кафедры офтальмологии КГБОУ ДПО «Институт повышения квалификации специалистов здравоохранения» Министерства здравоохранения Хабаровского края
Анализ офтальмологической литературы показывает, что сведения по вариантной микроанатомии и микротопографии структур глаза могут иметь прикладное значение для изучения этиопатогенеза целого ряда заболеваний органа зрения. Нарушения оттока водянистой влаги и её крайние формы в виде глаукомы являются распространенной и тяжелой патологией органа зрения (2). В целом ряде публикаций указывается на значение анатомических особенностей строения дренажного аппарата глаза в развитии глаукомы (1,3,6,7.8.9.10). Настоящая статья содержит анализ данных, полученных в микроанатомических исследованиях С.Б. Тулупова и А.В. Пряхина, выполненных под нашим руководством (4,5).
Ключевые слова: отток водянистой влаги, анатомические особенности трабеклярного аппарата
Венозный синус склеры.
Анатомическая изменчивость венозного синуса склеры складывается из различий его формы, количественных параметров, положения в склере.
По форме просвета венозного синуса склеры можно различать одноканальные и многоканальные синусы, а одноканальные – простой и сложной форм.
На меридиональных гистотопограммах различия одноканального синуса укладываются в диапазон от щелевидной формы до овальной с длинным передне-задним диаметром. Промежуточными являются синусы с равномерно-уплощенной формой просвета. В этих формах на поперечных срезах просвет шлеммова канала в переднем отделе сужен, имеет заостренный передний угол, а у заднего конца расширен и содержит неглубокие карманы.
При вышеуказанных формах передний отдел шлеммова канала отделен от просвета угла передней камеры наиболее тонкой трабекулярной сеточкой. По направлению кзади полость шлеммова канала косо поднимается к поверхности склеры и задний край венозного синуса оказывается в толще плотной склеральной ткани.
При сложных формах просвета венозного синуса канал в разных участках имеет неравномерный просвет, его расширения чередуются с резкими сужениями. Наблюдаются выраженные карманы, особенно в задней части просвета синуса.
Вариантами многоканальных синусов являются разнообразные формы. В одних случаях основной просвет синуса дополняется небольшим каналом вблизи заднего конца, в других – имеются 5-7 отделенных друг от друга каналов.
Различные формы просвета могут быть не только у разных людей (индивидуальные различия), но и в пределах одного глаза в разных секторах (межсекторальные различия).
Передне-задний диаметр шлеммова канала может изменяться в пределах от 0 до 0,7 мм при среднестатистическом значении 0,31±0,02 мм. В 77,2% наблюдений передне-задний диаметр находится в пределах 0,2 мм – 0,4 мм, а в 96,2%, т.е. в подавляющем числе наблюдений – в пределах 0,1 мм – 0,5 мм.
Особо следует отметить 7 глазных яблок, где венозный синус склеры в одном из сегментов отсутствовал, т.е. в этих случаях венозный синус склеры не представлял собой циркулярно замкнутого кругового сосуда.
Различия значений передне-заднего диаметра в разных секторах были примерно одинаковыми. В каждом секторе среднее значение передне-заднего диаметра составляло 0,28±0,02 мм - 0,33±0,02 мм. Наиболее частым вариантом был 0,3 мм, а большая часть наблюдений находилась в диапазоне 0,2-0,4 мм.
Только в трех глазных яблоках из изученных 49 (6,1%) шлеммов канал имел одинаковый передне-задний диаметр во всех секторах одного глазного яблока. Наиболее часто, более чем в половине глазных яблок (65,4%) эта разница составляла 0,1-0,2 мм. Еще более выраженной, в пределах 0,3-0,5 мм она имела место у 26,5% глазных яблок.
Поперечный диаметр венозного синуса склеры значительно меньше передне-заднего диаметра. Его значения находятся в пределах от 0 до 0,15 мм при среднестатистическом значении 0,07±0,01 мм. Межсекторальный анализ размеров поперечного диаметра не обнаружил существенных различий в разных секторах каждого глазного яблока.
Различия в микротопографии шлеммова канала наиболее демонстративны и существенны при рассмотрении положения шлеммова канала по отношению к углу передней камеры на меридиональных срезах. Эти различия определяются в основном индивидуально различной глубиной этого угла.
Оказалось возможным выделить три положения шлеммова канала по отношению к радужно-роговичному углу: переднее, среднее и заднее (рис. 1).
При переднем положении весь просвет шлеммова канала располагается впереди от угла. При этом, расстояние между задним краем синуса и вершиной угла может колебаться от 0,05 мм до 1,05 мм.
При среднем положении задний край просвета синуса находится на уровне вершины радужно-роговичного угла.
При заднем положении просвет синуса частично, максимально до границы между задней и средней третью его просвета, располагается кзади от вершины радужно-роговичного угла передней камеры глазного яблока.
Наиболее частым является переднее положение. Оно имело место в 44,7% наблюдений. Несколько реже, в 38% имеет место заднее положение и значительно реже (1,1%) его среднее положение.
| Рисунок 1. Различия в расположении венозного синуса склеры относительно угла передней камеры глаза на меридиональных гистотопограммах. Окраска по Ван-Гизону. Микрофотографии. Ок.7, об.8. А-переднее положение; Б-среднее положение; В-заднее положение.1-шлеммов канал; 2-склера; 3-ресничное тело; 4- трабекулярная сеточка; 5-угол передней камеры. |
| Рисунок 2. Различия строения стенок венозного синуса склеры на меридиональных гистотопограммах. Окраска по Ван-Гизону. Микрофотографии. Ок.7,об.8. 1-угол пердней камеры; 2-шлеммов канал; 3-трабекулярная сеточка; 4-склера; 5-артериальный сосуд. |
В зависимости от различий в положении шлеммова канала по отношению к радужно-роговичному углу наблюдаются различия в строении внутренней стенки шлеммова канала (рис. 2). Эти различия касаются главным образом
степени участия в ее формировании склеральной шпоры, которая образует ее заднюю часть.
В одних случаях склеральная шпора занимает до 1/3 внутренней стенки шлеммова канала. Такой вариант наблюдается преимущественно при заднем положении венозного синуса склеры.
В других случаях склеральная шпора практически не участвует в ее образовании, что наблюдается при переднем положении шлеммова канала.
При таких различиях трабекулярная сеточка занимает разную ширину внутренней стенки шлеммова канала: от 2/3 до всей ширины стенки.
Трабекулярная сеточка.
В трабекулярной сеточке выделяют 3 слоя: увеальный, корнеосклеральный и юкстаканаликулярный. Корнеосклеральная часть является основной. Юкстаканаликулярный слой представляет значительное препятствие для оттока жидкости из глаза.
Различия в строении трабекулярной сеточки касаются ее толщины, плотности, протяженности в передне-заднем направлении, или ширины отношения к просвету шлеммова канала (рис. 3).
Толщина трабекулярной сеточки может меняться в широких пределах от 0,05 до 0,5 мм.
Хотя диапазон различий трабекулярной сеточки широк, но подавляющее большинство этих структур (92%) имеет толщину 0,1-0,15 мм. Остальные варианты с наименьшей (0,05 мм) и наибольшей (0,2 и 0,5 мм) толщиной наблюдались в единичных случаях.
Различия в толщине трабекулярной сеточки обусловлены двумя факторами: количеством слоев трабекулярных волокон и плотностью их расположения.
Количество трабекулярных слоев в пределах роговично-склеральной части изменяется в пределах от 9 до 29. Индивидуально различна и плотность их расположения. По этому признаку трабекулярные сеточки в разных глазных яблоках могут быть разделены на две основные группы: с компактным и рыхлым расположением трабекулярных слоев, и, следовательно, с различной выраженностью фонтановых пространств.
Кроме того, на различия в толщине трабекулярной сеточки может оказывать влияние и выраженность юкстаканаликулярного слоя, максимальная толщина которого может достигать 40 мкм.
Различия в ширине трабекулярной сеточки в передне-заднем направлении в значительной мере совпадают с различиями в передне-заднем размере (или ширине) шлеммова канала. Как правило, роговично-склеральная часть трабекулярной сеточки находится в пределах внутренней стенки шлеммова
канала от его переднего конца на меридиональном срезе до склеральной шпоры сзади. Вместе с тем, на препаратах наблюдались случаи, когда трабекулярная сеточка распространялась и кпереди от шлеммова канала вплоть до границы с роговицей или даже составляла некоторую часть ее
внутренних слоев, а кзади заходила под склеральную шпору вместе с просветом венозного синуса.
Трабекулярная сеточка может составлять не всю внутреннюю стенку шлеммова канала, а только его часть, главным образом тогда, когда хорошо выражена склеральная шпора и она своей плотной соединительной тканью образует заднюю часть внутренней стенки шлеммова канала. Такие варианты
наблюдаются при заднем положении шлеммова канала. В этих случаях фильтрующая зона внутренней стенки шлеммова канала оказывается суженой.
Среди особенностей увеальной части трабекулярной сеточки выделяются обнаруженные случаи, когда ее трабекулы распространяются веерообразно кзади в пределы ресничного тела и соединяются с мышечными волокнами меридиональной части ресничной мышцы.
| Рис. 3. Крайние формы строения трабекулярной сеточки на меридиональных гистотопограммах. Окраска по Ван-Гизону. Микрофотографии. Ок. 7, об. 8. 1-шлеммов канал; 2-трабекулярная сеточка; 3-трабекула; 4-фонтановы пространства; 5-юкстаканаликулярный слой; 6-склеральная шпора; 7-угол передней камеры; 8-склера. |
Описанные морфологические различия трабекулярной сеточки, как нам представляется, имеют функциональный смысл, т.к. их следует рассматривать как основу различий интенсивности и возможностей фильтрации водянистой влаги через трабекулярную сеточку в шлеммов канал, участия в регуляции этого процесса склеральной шпоры и ресничной мышцы.
Отводящие сосуды.
Среди различных канальцев, отходящих от венозного синуса склеры, наибольшее внимание привлекают отводящие сосуды, описанные в 1942 г. Ашером под названием водяных вен.
Водяные вены обнаруживаются при биомикроскопическом исследовании в свете щелевой лампы в конъюнктиве или под ней. Они имеют бледную по сравнению с кровеносными сосудами окраску, характерно, что они начинаются в области лимба, а вена, в которую впадает водяная вена, отличается своеобразной слоистостью содержимого (K.W. Asher, 1942, 1949).
У человека водяные вены начинаются вблизи корнесклерального края в виде петлеобразного сосуда, поднимающегося из глубины ткани лимба и от эмиссариев склеры, расположенных на некотором расстоянии от лимба (K. Asher, 1942).
Такие сосуды довольно часто обнаруживаются на меридиональных гистотопограммах всех секторов глазного яблока примерно с одинаковой частотой.
Различия во внешнем строении водяных вен проявляются прежде всего в местах отхождения их на наружной стенке шлеммова канала. Эти различия могут быть сведены в три основных варианта (рис. 4).
При первом варианте водяная вена отходит от наружной стенки шлеммова канала у самого переднего края просвета. Она направляется кзади и кнаружи, имея прямолинейный ход и образуя острый угол с наружной стенкой шлеммова канала.
| Рис. 4. Различия в отхождении водяных вен от венозного синуса склеры: А-переднее; Б-среднее; В-заднее. Окраска по Ван-Гизону. Микрофотографии. Ок. 7, об. 8. 1-шлеммов канал; 2-водяная вена; 3-трабекулярная сеточка; 4-склера. |
При втором варианте водяная вена отходит от середины наружной стенки шлеммова канала также под острым углом, направляясь кзади и кнаружи.
При третьем варианте водяная вена отходит от задней половины наружной стенки шлеммова канала, являясь на гистотопографическом срезе как бы его продолжением кзади.
В ряде случаев просвет выносящих сосудов оказывается закрытым трабекулами трабекулярной сеточки, которые проникают в полость шлеммова канала при сложных формах просвета венозного синуса.
Кроме различий в расположении начала водяных вен имеются различия в форме их начального отрезка и углах отхождения.
Начало водяной вены может сразу приобретать диаметр, равный диаметру водяной вены на протяжении. Она также может иметь вид начального расширения или воронки.
Большинство водяных вен отходит от шлеммова канала под острыми углами, открытыми кзади. Вместе с тем, наблюдаются случаи, когда водяная вена отходит от шлеммова канала под прямым углом и, только пройдя некоторое расстояние кнаружи, поворачивала назад.
Водяные вены, впадающие в эписклеральное венозное русло в 2,5-3,0 мм от лимба, могут иметь короткий ход и резко косо подниматься к поверхности
склеры в проекции ресничного тела. Другие водяные вены имеют пологий ход на протяжении и вливаются в эписклеральные сосуды позади заднего края проекции ресничного тела в 3,5-4,0 мм от лимба.
В ряде случаев после выхода из шлеммова канала выносящие сосуды образуют сплетение в глубоких слоях склеры. Просвет сосудов такого сплетения 10-100 мкм. Глубокое сосудистое сплетение, распространяясь кзади, располагается в проекции ресничного тела в 2,0-3,0 мм от лимба.
Заключение.
Таким образом, имеются индивидуальные различия в передне-заднем положении шлеммова канала относительно угла передней камеры, индивидуально различное положение трабекулярной сеточки, вариабельность ее трабекулярных слоев, степень выступания на внутренней стенке шлеммова канала склеральной шпоры, различия водяных вен.
Эти различия могут обуславливать индивидуально различные анатомо-функциональные возможности фильтрации и оттока водянистой влаги.
Заднее положение венозного синуса склеры, максимальное количество трабекулярных слоев, их плотное расположение, максимальная толщина юкстаканаликулярного слоя трабекулярной сеточки, значительное выступание склеральной шпоры на внутренной стенке венозного синуса склеры могут наряду с другими этиопатогенетическими факторами рассматриваться как анатомо-функциональный фон развития глаукомы.
Литература
- Каминская З.А. Глаукома и «водянистые вены» // Вестн. офтальм. - №5. – 1950.
- Нестеров А.П. Глаукома. – М.: Медицина. – 1995.
- Нестеров А.П., Батманов Ю.Е. О некоторых особенностях оттока водянистой влаги из глаза // Вест. офтальм. – 1971. - №5. – С. 3-10.
- Пряхин А.В. Различия в анатомическом строении и микротопографии кровеносного русла ресничного тела глаза и его изменения при местном нарушении кровообращения. – Автореферат дис. … канд. мед. наук. Оренбург, 2006. – 26 с.
- Тулупов С.Б. Различия в макромикроскопическом строении и топографии структур цилиарно-ангулярной зоны глазного яблока. – Автореферат дис. …канд. мед. наук. – Оренбург, 2001. – 20 с.
- Asher K.W. Aqueous veins and their significance of pathogenesis of glaucoma // Arch. Ophth., 42. – 1949. – P. 66-67.
- H., Tripathi R.C., Tripathi B.J. Morphology of the aqueous out flow pathway // Microsc. Res. Tech. – 1996. – 33. – P. 336-367.
- Kariukina L.N., Batmanov I.E. External wall of Schlemm's canal and the adjoining sclera normally and in open-angle glaucoma // Vestn. Oftalmol. – 1982. – P. 3-6.
- Seiler T., Wollensak J. The resiistance of the trabecular meshwork to aqueous humor outflow // Graefes Arch. Clin. Exp. Ophthalmol. – 1985. – 223. – P. 88-91.
- Thomassen T.L., Perkins E.S. a. Dobree J.H. Aqueous veins in glaucomatous eyes // Brit. J. Ophth. 34. – 1950. – P. 221-227.
к содержанию опубликовать статью
РЕГЕНЕРАЦИЯ РОГОВОЙ ОБОЛОЧКИ ПОСЛЕ ХИМИЧЕСКОГО ОЖОГА В УСЛОВИЯХ ПРИМЕНЕНИЯ НАНОСТРУКТУРИРОВАННОГО БИОМАТЕРИАЛА
В.Н. Канюков, А.А. Стадников*, О.М. Трубина, О.М. Яхина
Оренбургский филиал ФГБУ МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова
Минздрава России
*ГБОУ ВПО «Оренбургский государственный медицинский университет»
Минздрава России
В ходе проведенного экспериментального исследования получены данные, свидетельствующие об оптимизации процессов эпителизации раневой зоны, стимуляции митотической активности базальных и шиповатых клеток переднего эпителия, лимитировании апоптотической доминанты эпителиоцитов и фибробластов собственного вещества роговицы в условиях применения наноструктурированного биоматериала, что также было подтверждено иммуноцитохимическим исследованием. Применение аппликации наноструктурированного биопластического материала на начальном этапе лечения химического ожога роговицы способствовало стабилизации эпителио-соединительнотканных взаимоотношений в более ранние сроки эксперимента, создавало условия для ускорения эпителизации, а так же способствовало сокращению течения экссудативной фазы воспаления, более быстрому переходу в завершающую пролиферативную фазу и сокращению сроков реабилитации.
Ключевые слова: наноструктурированный биоматериал, ожог роговицы, эксперимент, гиалуроновая кислота, регенерация, асептическое воспаление, nanostructured biomaterial, corneal burn, experiment, hyaluronic acid, regeneration, aseptic inflammation
Цель работы - изучить течение щелочного и кислотного ожогов роговицы при применении наноструктурированного биопластического материала на основе гиалуроновой кислоты.
Материал и методы.
Работа носила экспериментальный характер и выполнена на 36 кроликах (72 глаза) в 2-х сериях: в 1-ой серии эксперимента формировали щелочной (18 кроликов), а во 2-ой серии - кислотный ожог роговицы (18 кроликов), при этом в опытной группе оценивали влияние «Гиаматрикса» на репаративные процессы, а в контрольной - применяли глазной гель Солкосерил.
«Гиаматрикс» - это биопластический материал, полученный из исходного гидрогеля гиалуроновой кислоты, который подвергали воздействию ультрафиолетового облучения. Он разрешен к применению в общей и пластической хирургии (регистрационное удостоверение ФСР 2011/10313 от 18.03.2011) [4].
Состояние животных оценивали клинически по признакам: характер инъекции конъюнктивы и ее выраженность, отек конъюнктивы, диаметр дефекта роговицы после окрашивания 0,1 % раствором флюоресцеина натрия, интенсивность помутнения роговицы. На сроках 3, 7, 14, 30 и 90 суток животных выводили из эксперимента для проведения светооптической и электронной микроскопии, иммуноцитохимических исследований.
Результаты.
После воздействия на роговицу 2,5% раствором гидроксида натрия определяли степень отека и гиперемию конъюнктивы, помутнение верхних слоев роговицы, дефект эпителия, прокрашивающийся флуоресцеином в виде круга диаметром 7мм. В опытной группе на 3 сутки дефект уменьшился до 3,5мм, в то время как в контрольной группе он был равен 5мм в диаметре.
В опытной группе при оценке стромального помутнения у всех экспериментальных животных оно занимало оптическую зону роговицы и сохранялось до 7 суток, а к 14 суткам уменьшалось до размеров круга диаметром 4мм, на месте которого формировалось стойкое помутнение. Тем временем, как в контрольной группе оно сохранялось до 30 суток, на месте помутнения отмечали формирование стойкого помутнения.
На сроке наблюдения 30 суток у 4 кроликов опытной группы и 5 кроликов контрольной группы отмечали неоваскуляризацию, на сроке 90 суток у экспериментальных животных опытной группы формировалось нежное поверхностное помутнение, занимающее 1/3 часть роговицы, в то время как в контрольной группе помутнение было грубым и занимало 2/3 роговицы.
Клиническое исследование показало, что сразу после действия 3 % раствора уксусной кислоты, несмотря на отсутствие прокрашивания роговицы флюоресцеином, отмечались признаки роговичного синдрома: блефароспазм, светобоязнь, слезотечение. При биомикроскопии определяли инъекцию конъюнктивы, помутнение роговицы в области контакта с детергентом за счет отека эпителия. Отек роговицы на всех глазах опытной группы сохранялся до 7-ми суток, в то время как в контрольной группе до 14 суток. Инъекция конъюнктивы в опытной группе усиливалась в первые 3-е суток после аппликации, что могло быть связано с фиксацией мягкой контактной линзы, затем отмечалась положительная динамика и полное исчезновение инъекции к 8-9 суткам. В контрольной группе инъекция конъюнктивы уменьшалась медленнее и проходила полностью к 14 суткам.
Морфологические исследования течения щелочного ожога свидетельствовали о том, что повреждение переднего эпителия закономерно приводило к изменению местного обмена веществ; кроме того развивалась интоксикация продуктами распада поврежденных клеток, которая особенно была выражена в виду анатомических особенностей строения роговицы и ее кровоснабжения. Клинически это проявлялось резким увеличением отека и инъекции конъюнктивы, отеком роговицы, блефароспазмом, светобоязнью, слезотечением, помутнением роговицы в первые 7-10 суток, что характерно для острой фазы ожога. Повреждались не только те ткани, которые были подвергнуты прямому воздействию щелочи, но и глубжележащие структуры.
Светооптическое исследование показало, что на сроке 3-х суток щелочного ожога в обеих группах наблюдалась десквамация клеток переднего эпителия, отек и дискомплексация волокон собственного вещества роговицы (рис. 1), но при применении биополимера гиалуроновой кислоты кроме этого отмечалось лимитирование эпителизации раневой поверхности роговицы (рис. 2).
 |
| Рисунок 1. Световая микроскопия. Щелочной ожог роговицы, 3 сутки, контрольная группа. Увеличение: 400. Окраска: гематоксилин-эозин. Отек и дискомплексация волокон собственного вещества роговицы. Десквамация клеток переднего эпителия. Окраска: гематоксилин. |
 |
| Рисунок 2. Световая микроскопия. Щелочной ожог роговицы, 3 сутки, опытная группа. Увеличение: 80. Окраска: гематоксилин-эозин. Лимитирование эпителизации раневой поверхности роговицы. |
На сроке 7-ми суток, на глазах опытной группы обнаруживали эпителиальные пролифераты погружного и покровного характера и отмечали наличие новообразованного эпителиального пласта в центральной зоне повреждения структур роговицы (рис. 3), а в контрольной группе лишь формирование малодифференцированной соединительной ткани (рис. 4).
 |
| Рисунок 3. Световая микроскопия. Щелочной ожог роговицы, 7 сутки, опытная группа. Увеличение: 400. Окраска: гематоксилин-эозин. |
 |
| Рисунок 4. Световая микроскопия. Щелочной ожог роговицы, 7 сутки, контрольная группа. Увеличение: 400. Окраска: гематоксилин-эозин. Формирование малодифференцированной соединительной ткани |
Существенным являлось то обстоятельство, что по мере продолжения развития деструктивного процесса (сроки 7 и 14 суток) в прилежащих к некротизированным тканям участках, возникало выраженное вторичное реактивное воспаление. Оно характеризовалось вазодилятацией кровеносных сосудов, экстравазацией плазмы и форменных элементов крови с формированием демаркационной зоны. Демаркационная линия в исследованных участках глаза была выражена слабо, а в лимбальной зоне она отсутствовала. Это приводило к утяжелению и прогрессированию некротических процессов эпителиальных и соединительнотканных структур.
Альтерация тканей роговицы не сопровождалась адекватной экссудативной (сосудистой) и продуктивной (пролиферативной) реакциями, что свидетельствовало о сохранении дистрофических процессов в моделируемых условиях. Таким образом, фокус воспаления в связи с процессами экссудации не в полной мере выполнял дренажную и элиминативную функции при ожоговой травме роговицы.
Преобладающее большинство эмигрирующих лейкоцитов составили сегментоядерные нейтрофилы. Помимо них, значительно реже экстравазации подвергались лимфоциты, моноциты, базофильные гранулоциты и эозинофилы. Данные клетки продвигались в зону повреждения роговицы между волокнистыми структурами по направлению к центру воспаления, где и наблюдалось их наибольшее скопление.
В области повреждения роговицы и прилежащих участков конъюнктивы по мере угасания воспалительного процесса происходила активизация камбиальных клеток и клеток фибробластического дифферона. При этом образовывались волокнистые структуры без разрастаний эпителиальной ткани. Обобщая полученные результаты, можно сделать вывод о том, что щелочное повреждение роговицы экспериментальных животных (кроликов) приводило к развитию некротического воспаления.
На фоне восстановления гемомикроциркуляции (до 3-х месяцев с момента ожога) развивались пролиферативные и регенераторные процессы, которые обеспечивали впоследствии образование коллагеновых волокон и межуточного вещества стромы поверхностных тканей глаза. В процессе регенерации участки некроза ткани заполнялись не специфической стромальной тканью, а соединительной с формированием рубца.
На протяжении стадии ранних исходов ожогового процесса, до 90 суток с момента ожога, субэпителиально осуществлялись фибропластические процессы, формировалась грануляционная ткань.
В сроки свыше 2-х недель процессы как в опытной, так и в контрольной группах были сходными, ведущими к стабилизации раневого процесса. Однако их завершение в опытной группе проходило быстрее. Для подтверждения этого было проведено иммуноцитохимическое исследование, которое показало, что при применении наноструктурированного биополимера гиалуроновой кислоты снижалась апоптотическая доминанта эпителиоцитов и фибробластов роговицы, взятой для исследования на 3-и и 15-ые сутки эксперимента. С другой стороны, возрастала экспрессия синтеза протеина bcl2, что свидетельствовало о выраженности пролиферативной фазы воспаления. Таким образом, результаты иммуноцитохимического исследования подтверждали тот факт, что аппликация наноструктурированного биополимера гиалуроновой кислоты оптимизировала репаративные гистогенезы с включением механизмов лимитирования экспрессии проапоптатического гена p 53, снижая число иммунопозитивных эпителиоцитов в 2,5-3 раза по сравнению с контрольной группой.
Морфологические изменения роговицы при кислотном ожоге имели особенности, обуславливающие соответствующую клиническую картину. Они представляли собой коагуляционный некроз поверхностных слоев с формированием плотного струпа на роговице, что обусловило роговичный синдром, но не дало возможности прокрашивания стромы флуоресцеином. На сроке наблюдения 3-х суток как в опытной, так и в контрольной группах светооптическое исследование показало, что клетки переднего эпителия роговицы были повреждены, в мелких сосудах формировались тромбы, при этом плазма выходила в окружающие ткани, что клинически проявлялось отеком конъюнктивы. Кроме деструктивных изменений эпителиоцитов, отмечались нарушения в строме, которые строго соответствовали участку ожога и захватывали не менее 1/3 толщины стромы. Морфологически определяли признаки токсического действия продуктов распада поврежденных клеток. Таким образом, при кислотном ожоге в отличие от щелочного ожога, возникал коагуляционный (сухой) некроз - кислотная денатурация белков, благодаря которой кислота не проникала в подлежащие слои ткани.
При иммуноцитохимическом исследовании так же как и при щелочном ожоге снижалась апоптотическая доминанта эпителиоцитов и фибробластов, но возрастала экспрессия синтеза протеина bcl 2, свидетельствующая о выраженности пролиферативной фазы воспаления.
На сроке от 30-ти суток и выше наблюдали завершение фибробластических процессов как в опытной, так и в контрольной группе.
Заключение.
Полученные данные в ходе проведенного экспериментального исследования свидетельствуют об оптимизации процессов эпителизации раневой зоны, стимуляции митотической активности базальных и шиповатых клеток переднего эпителия, лимитировании апоптотической доминанты эпителиоцитов и фибробластов собственного вещества роговицы в условиях применения наноструктурированного биополимера гиалуроновой кислоты, что также было подтверждено иммуноцитохимическим исследованием.
Применение аппликации наноструктурированного биопластического материала на начальном этапе лечения химического ожога роговицы способствовало стабилизации эпителио-соединительнотканных взаимоотношений в более ранние сроки эксперимента, создавало условия для ускорения эпителизации, а так же способствовало сокращению течения экссудативной фазы воспаления, более быстрому переходу в завершающую пролиферативную фазу и сокращению сроков реабилитации.
Список литературы
- Дадашева, З.Р. Хирургическая тактика при лечении тяжелой и особо тяжелой ожоговой травмы глаз / З.Р. Дадашева, // автореф. дисс. …канд. мед. наук. - Москва. - 2004. – 22с.
- Макаров, П.В. Лимбальная трансплантация в хирургической реабилитации пациентов, перенесших тяжелые ожоги глаз / П.В. Макаров [и др.] / Вестник офтальмологии. – 2007. - Т. 123.- № 3. – С. 13-16.
- Мороз, З.И. Современные направления хирургического лечения патологии роговицы / З.И. Мороз // Cъезд офтальмологов России, 9-й: Тезисы докладов – М.: Издательство «Офтальмология», 2010. – С. 298-299.
- Рахматуллин, Р.Р. Биопластический материал на основе гиалуроновой кислоты: биофизические аспекты фармакологических свойств / Р.Р. Рахматуллин // Фармация. - № 4. – 2011. – С. 36-39.
- Севостьянов, А.Е. Использование фитоэкдистероида (экдистен) при заболеваниях роговицы с повреждением переднего эпителия (экспериментально-клиническое исследование) / А.Е. Севостьянов // - автореф. дисс. …канд. мед. наук. - Самара. - 2010. - 24с.
- Ульянов А. Н. Первый опыт реконструкции поверхности роговицы методом конъюнктивально-лимбальной трансплантации в реабилитации пациентов с ожоговыми бельмами / А. Н. Ульянов, О.В. Шиловских, О.Б. Фечин // Офтальмохирургия - 2008. – № 1. – С. 9-12.
- Corneal regeneration following implantation of a biomimetic tissue-engineered substitute / P. Fagerholm [et al.] // Clin. Trans. Sci. – 2009. – Vol. 2. – P. 162-164.
- Schwab, I. Successful transplantation of bioengineered tissue replacements inpatient with ocular surface disease / I. Schwab, M. Reyes, R.R. Isseroff // Cornea. — 2000. — Vol. 343.— P. 421—426.
к содержанию опубликовать статью
РЕКОНСТРУКТИВНАЯ ХИРУРГИЯ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ КОЖИ ВЕК И ПЕРИОРБИТАЛЬНОЙ ОБЛАСТИ
А.Н. Демаков (1), Г.Н. Стрижаков (1,2), Е.В. Корчагин (1), Л.А. Карамчакова (3)
1 - ГБУЗ Республики Хакасия «Республиканский клинический онкологический диспансер», г. Абакан
2 - ГОУ ВПО «Хакасский государственный университет им. Н.Ф. Катанова», г. Абакан
3 - ГБУЗ Республики Хакасия «Республиканская клиническая офтальмологическая больница имени Н.М.Одежкина», г. Абакан
Злокачественные новообразования кожи, включая меланому, занимают ведущее место в структуре онкологической заболеваемости. Лечение опухолей кожи век и периорбитальной области требует взаимодействия специалистов разных направлений и объединяет две специальности онкологию и офтальмологию. Хирургическое лечение таких новообразований возможно при наличии специальных знаний и навыков в сфере пластической реконструктивной хирургии для достижения оптимальных функциональных и эстетических результатов.
Ключевые слова: новообразования век, новообразования периорбитальной области, реконструктивная хирургия,
Целью настоящего исследования явилось изучение непосредственных и отдаленных результатов реконструктивных операций при опухолях век и периорбитальных областей.
Материал и методы. 68 пациентам, находившимся на лечении в отделениях онкодиспансера республики Хакасия с 2009 по 2013 годы со злокачественными первичными и рецидивными новообразованиями кожи век и окологлазничных областей, было произведено 73 операции. Мужчин 35, женщин 33. Возраст - от 36 до 89 лет. Преобладал базальноклеточный рак кожи в 70 случаях, плоскоклеточный в 2-х, меланома кожи в 1-м. Стадия рака кожи T1N0M0 – 47 пациентов, T2N0M0 – 15, T3N0M0 – 5, T4N0M0 – 2, меланомы - pT1bN0M0. Во всех случаях при рецидивах распространенный процесс – rT4N0M0: после хирургического лечения в другом учреждении – 2, после лучевой терапии – 1. По поводу первичных опухолей 70 операций. Закрытие дефектов прямым сшиванием удалось выполнить у 55 пациентов.
Выполнены 18 различных реконструктивных операций (24,66%) пациентам с распространенным опухолевым процессом (T3-4), которые вошли в исследование.
Для пластического закрытия дефектов применялись различные лоскуты: осевые (парамедианный), со случайным типом кровоснабжения (ромбовидный, глабеллярный, тарзоконъюнктивальный, ротационный со щеки, V-Y лоскут). Тотальные и субтотальные полнослойные дефекты верхнего и нижнего век закрывали тарзоконъюнктивальным лоскутом в комбинации с ротационным или ромбовидными кожными лоскутами со щеки, дефекты конъюнктивы восстанавливали аутотрансплантатом слизистой щеки.
Результаты. В одном случае после операции развился тотальный некроз ромбовидного кожного лоскута, укрывающего тарзоконъюнктивальный лоскут, у возрастной пациентки с наличием сопутствующего сахарного диабета. Другие ранние послеоперационные осложнения отсутствовали.
Недостаточное смыкание век в отдаленном послеоперационном периоде отмечено в 2-х случаях после реконструкции нижнего века по поводу субтотального и тотального дефектов при распространенном опухолевом процессе (T3, T4). Обе возрастные пациентки были удовлетворены результатами операций и отказались от предложенной коррекции.
Все пациенты осмотрены на предмет прогрессирования в сроки от 1,5 до 5-и лет, местных рецидивов и метастазов не отмечено.
Заключение. Методически правильный выбор реконструктивных операций в хирургии век и окологлазничной области в онкологии позволяет производить радикальное иссечение пораженных тканей. Адекватная хирургическая тактика снижает риск местных рецидивов, позволяет восстанавливать функцию вспомогательного аппарата глаза, и минимизирует эстетические потери для этой сложной группы пациентов.
к содержанию опубликовать статью
РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОФТАЛЬМОПАТОЛОГИИ ПО МЕТОДУ АЛЛОПЛАНТ
Федотов А.А., Павлова Н.И.
ГБУ РО «КБ имени Семашко Н.А.», г. Рязань
Хронические дегенеративные изменения сетчатки и зрительного нерва являются наиболее частой причиной необратимой слепоты в мире (М.Н. Островская, 1963г.). Наиболее перспективным подходом к лечению данного вида патологии является активизация собственных регенеративных возможностей организма. Хирургическое лечение по методу Аллоплант предполагает направленную тканевую регенерацию тканей у больных с различными видами офтальмопатологии. Операции по методу Аллоплант стали производиться в нашей клинике с 2005 года после обучения хирургов во Всероссийском центре глазной и пластической хирургии в г. Уфе и получения сертификата на данную деятельность
Ключевые слова:
Цель работы изучить эффективность хирургического лечения больных с хроническими дегенеративными изменениями сетчатки и зрительного нерва по методу Аллоплант.
Материалы и методы исследования.
Прооперировано 196 глаз с различными видами хронических дегенеративных изменений сетчатки и зрительного нерва.
Производились следующие вмешательства:
- Реваскуляризация хориоидеи с использованием стимулятора васкулогенеза или стимулятора фагоцитоза - 68 глаз.
- Реваскуляризация хориоидеи с задней аутолимфосорбцией - 12 глаз.
- Ретросклеропломбирование по методу Аллоплант - 110 глаз.
- Реваскуляризация зрительного нерва - 6.
Во всех операциях использованы биоматериалы, приобретенные в тканевом банке Всероссийского центра глазной и пластической хирургии. Срок наблюдения за больными - от 1 месяца до 6 лет.
Структура патологии:
- Различные виды глаукомы - 68 глаз.
- Атрофия зрительного нерва - 6 глаз.
- Макулодистрофия - 64 глаза.
- Дегенеративная миопия - 51 глаз.
- Диабетическая ретинопатия -7 глаз.
44% прооперированных больных имели группу инвалидности по зрению.
Результаты исследования.
Операционных осложнений не отмечалось. В одном случае, при сочетании нестабилизированной глаукомы, артифакии и высокой близорукости потребовалась дополнительная антиглаукомная фильтрующая операция. Время наблюдения за больными составило от 1 месяца до 6 лет.
Результаты лечения больных с различными видами глаукомы по методу Аллоплант.
Всего по методу Аллоплант прооперировано 68 глаз. (59- с открытоугольной глаукомой, 8 глаз - с закрытоугольной глаукомой, 1 - с врожденной глаукомой). Всем больным производилась операция РСП по методу Аллоплант.
По нашим наблюдениям наибольшее увеличение зрительных функций наблюдалось через месяц после операции, причем результат зависел от исходных функций глаза: чем выше были исходные зрительные функции тем более значительный эффект от операции можно было ожидать. При наблюдении за больными более года, стабилизация зрительных функций наблюдалась у 95% больных.
Таблица №1. Результаты хирургического лечения по методу Аллоплант больных с глаукомой.
Разновидность глаукомы |
Количество глаз |
Количество больных с увеличением зрит. функций более 0,1 |
Количество больных с увеличением зрит.функций на 0,1 |
Количество больных со стабил. зрит. функций, без улучшения зрения |
Количество больных со стабилизацией зрит. функций через 1 год |
| Открытоугольная глаукома | 59 | 3 | 24 | 32 | 55 |
| Закрытоугольная глаукома | 8 | 0 | 3 | 5 | 8 |
| Врожденная глаукома | 1 | 1 | 0 | 0 | 1 |
Результаты хирургического лечения больных с атрофией зрительного нерва по методу Аллоплант.
Всего прооперировано 6 глаз . Производилась реваскуляризация зрительного нерва со стимулятором васкулогенеза. Полученные результаты зависели от исходного уровня зрительных функций. Улучшение зрения добились у 33% больных этой подгруппы, стабилизацию через год - у всех.
Таблица №2. Результаты хирургического лечения по методу Аллоплант больных с атрофиями зрительного нерва.
| Этиология процесса | Количество больных | Стабилизация зрит. функций | Улучшение зрит. функций | Отсутствие стабилизации зрит. функций |
| Сосудистая атрофия зрительного нерва | 2 | 1 | 1 | 0 |
| Посттравматическая атрофия зрит. Нерва | 1 | 1 | 0 | 0 |
| Врожденная атрофия зрит. Нерва | 2 | 1 | 1 | 0 |
| Атрофия неясной этиологии | 1 | 1 | 0 | 0 |
Результаты лечения по методу Аллоплант больных с различными видами макулодистрофии.
Всего прооперировано 64 глаза. Производились следующие операции: реваскуляризация хориоидеи со стимулятором васкулогенеза, РСП по методу Аллоплант (2 этап операции).
Интересны результаты операции по методу Аллоплант при пигментном ретините (12 глаз). Известно, что данное заболевание развивается в молодом работоспособном возрасте и неизменно и быстро прогрессирует. Нами при данной патологии производилась реваскуляризация хориоидеи со стимулятором васкулогенеза. Большинство больных прооперировано на двух глазах, практически у всех больных отмечался положительный эффект: повышалась острота центрального зрения, улучшалась темновая адаптация, субьективно отмечалось более четкое и яркое изображение предметов. К сожалению, далеко не все больные попадали в поле зрения через 2-3 года после операции, однако те, кто являлся на контрольный осмотр, радовали стабилизацией зрительных функций.
При макулодистрофиях результат зависел не только от исходных функций глаза, но и от вида дистрофических изменений сетчатки. Хорошие результаты получены при сенильных дистрофиях (50 глаз), особенно влажных и геморрагических формах, более скромные - при грубых псевдотуморозных ценральных очагах (2 глаза), в этом случае лишь незначительно расширились поля зрения, а центральное зрение существенным образом не изменилось.
Таблица №3. Результаты хирургического лечения по методу Аллоплант больных с макулодистрофиями.
Разновидности макулодистрофии |
Количество больных |
Улучшение зрит. функций |
Стабилизация зрит. функций через 1 год |
Отсутствие стабилизации через 1 год |
| Пигментный ретинит | 12 | 5 | 7 | 0 |
| Возрастная дегенерация сетчатки | 50 | 19 | 31 | 0 |
| Макулодистрофия с неоваскулярной мембраной и псевдотуморозная форма | 2 | 0 | 1 | 1 |
Выводы
- Хирургическое лечение по методу Аллоплант эффективно при хронических дегенеративных состояниях сетчатки и зрительного нерва.
- Улучшение зрительных функций в послеоперационном периоде зависело от исходных функций глаза: чем были выше исходные функции глаза, тем больше прибавка после операции.
- Эффективность операций по методу Аллоплант при макулодистрофии зависела от вида дистрофических изменений - наилучшие результаты получены при пигментном ретините, влажных формах сенильной дистрофии сетчатки.
- Стабилизация патологического процесса у больных с хроническими дегенеративными изменениями сетчатки и зрительного нерва после реваскуляризирующих операций достигнута у 95% обследованных пациентов.
к содержанию опубликовать статью
ОТДАЛЁННЫЕ РЕЗУЛЬТАТЫ ПЕРВИЧНОЙ ХИРУРГИЧЕСКОЙ ОБРАБОТКИ ОБШИРНЫХ ПОВРЕЖДЕНИЙ СКЛЕРЫ С ИСПОЛЬЗОВАНИЕМ ЭНДОВИТРЕАЛЬНЫХ МАТЕРИАЛОВ
Степанянц А.Б., Аладинский Е.Б.
ГБОУ ВПО УГМУ Минздрава России, МБУ ЦГКБ № 23, г. Екатеринбург
Обширные повреждения склеры являются одним из наиболее тяжёлых видов открытой травмы органа зрения, и их тяжесть определяется сопутствующими нарушениями: выпадением внутренних оболочек, потерей стекловидного тела и др., которые и приводят к резкому снижению или полной потере зрительных функций [1, 2 ]. Результаты экспериментальных исследований и клинические наблюдения показали, что ведущим звеном патогенеза открытой травмы глаза, определяющим тяжёлый исход, является витреоретинальная пролиферация. Её основной причиной являются патологическая фиксация стекловидного тела, кровь, излившаяся в витреальную полость, реакция на альтерацию и воспаление внутриглазных тканей. В витреальной полости формируются патологические мембраны, тяжи, фиксирующиеся к внутренним оболочкам глаза. Сокращение патологических структур приводит к тракционной отслойке сетчатки, цилиарного тела, с развитием в дальнейшем субатрофии глазного яблока [3-5]. Основной проблемой у пострадавших с подобным видом травмы является трудность правильного сопоставления краёв обширной раны (или субконъюнктивального разрыва склеры - СРС), особенно при их распространении к заднему полюсу глаза и профилактики послеоперационных осложнений во время проведения первичной хирургической обработки (ПХО).
Ключевые слова: обширные повреждения склеры, эндовитреальные материалы, первичная хирургическая обработка
Цель. Показать эффективность предложенного способа хирургической обработки обширных повреждений склеры на примере анализа результатов лечения, проведённого через 6 месяцев после выписки травмированных.
Материалы и методы. Ежегодно в отделение офтальмотравматологии МБУ ЦГКБ № 23 поступают более 100 пациентов с подобной патологией. 20 пациентов, лечившихся по поводу обширных повреждений склеры (проникающая рана или СРС длиной более 10 мм) были разделены на исследуемую и контрольную группу по 10 человек в каждой. Сроки поступления в стационар от момента травмы составляли от 2 часов до 3 суток, среднее время пребывания в стационаре - 10 суток. О тяжести данной разновидности открытой травмы глаза свидетельствовали низкие зрительные функции у пострадавших обеих групп при госпитализации в стационар: в каждой группе у 5 пациентов определялось светоощущение с неправильной проекцией, у 3 - правильная проекция света, у 2 - сохранено предметное зрение (0,01-0,03).У всех травмированных отмечалась выраженная гипотония глазного яблока, гифема различной интенсивности, массивный гемофтальм.
В контрольной группе пациентам в экстренном порядке проводилась стандартная ПХО обширного повреждения склеры с шовной герметизацией раны. Выпавшее стекловидное тело иссекалось. Для герметизации раны применялись отдельные узловые швы 8:0 с шагом 1 мм. В исследуемой - дополнительно к стандартной ПХО, после наложения 1-3 швов, в стекловидное тело вводилось 0,2-0,3мл офтальмологического вязкоэластичного раствора "Вискомет". Благодаря своей эластичности, вискомет восстанавливал внутриглазное давление (ВГД), глаз приобретал шарообразную форму, что облегчало дальнейшее наложение швов и герметизацию раны. Затем, интравитреально вводили 0,2мл ПФОС (октофлюоропропан) С3F8 в 20% смеси с воздухом, последующее увеличение объёма газа внутри глазного яблока обеспечивало плотное прилегание оболочек и местное сдавление сосудов, что и снижало вероятность рецидива гемофтальма и отслойки сетчатки в послеоперационном периоде. После герметизации раны выполнялось экстрасклеральное пломбирование постоянной пломбой с шовной фиксацией последней к склере «П» или «Z»-образными швами 8:0. Удаление вискомета и газа из витреальной полости в послеоперационном периоде не проводилось, учитывая небольшой объём введённых веществ и их низкую токсичность (Способ хирургического лечения обширных повреждений склеры. Патент № 2479292 от 20.04.13).
Результаты: В послеоперационном периоде все пациенты обеих групп получали идентичную антибактериальную, противовоспалительную и гемостатическую терапию. Контрольный осмотр состояния органа зрения осуществлялся по данным визометрии, биомикроскопии, офтальмоскопии, УЗ АВ-сканирования и тонометрии через 1, 3 и 6 месяцев после выписки. Оценивались: острота зрения, ВГД и длина глазного яблока (ПЗО). В исследуемой группе у 3 пациентов было выявлено светоощущение с неправильной проекцией, у 3 - правильная проекция света, у 4 - предметное зрение (от 0,05 до 0,2). Лишь в одном случае была выявлена умеренная субатрофия глазного яблока со снижением ВГД ниже 14 мм и ПЗО меньше 19 мм. У остальных 9 пациентов ВГД определялось в пределах 17-20 мм, ПЗО от 20 до 24 мм. В контрольной группе по остроте зрения данные распределились следующим образом: у 6 пациентов - неправильная проекция света, у 3 - правильная проекция света, у 1 - было сохранено предметное зрение 0,02. В 5 случаях выявлялась субатрофия глазного яблока с гипотонией (ВГД менее 14 мм) и снижением значения длины ПЗО менее 19 мм, причём у двух пострадавших наблюдалась выраженная субатрофия с витреофиброзом и отслойкой сетчатки. В 5 случаях ВГД и значение ПЗО соответствовали норме.
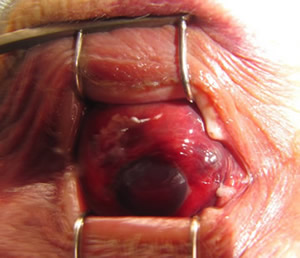 |
| Рис. 1. СРС при госпитализации |
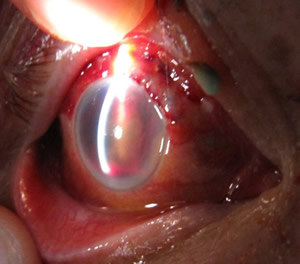 |
| Рис. 2. СРС, 5-е сутки после ПХО |
| Рис. 3 - 5. Этапы ПХО СРС |
| Рис. 6 - 8. Исход СРС через 1 мес; 0,5 года; исход СРС в субатрофию в контрольной группе |
Выводы. Данные нашего исследования свидетельствуют, что предложенный метод хирургической обработки обширных повреждений склеры с использованием эндовтреальных материалов является более эффективным по сравнению со стандартной методикой и позволяет значительно снизить риск развития субатрофии глазного яблока в отдалённом послеоперационном периоде.
Литература
- Гундорова Р.А., Кашников В.В. Повреждения глаз в чрезвычайных ситуациях. - Новосибирск, 2002. - 240 с.
- Дудник Н.С. О причинах развития ранней субатрофии глаза при проникающем ранении склеры и цилиарного тела //Ерошевские чтения. – Самара, 2002.-С.339-341.
- Шишкин М.М. Передняя пролиферативная витреоретинопатия (патогенез, лечение, профилактика): Автореф. дис. … д-ра. мед. наук. СПб., 2000.-51с.
- Шишкин М.М., Миронов А.В. К вопросу о сроках первичной хирургической обработки при открытой травме глаза с повреждением заднего сегмента // Поражения органа зрения. Материалы юбилейной науч. конф., посвящённой 190-летнему основанию каф. офтальмологии ВМА.- С.-Петербург, 2008.-С. 182.
- Эль-Жухадар В.Х. Особенности развития раневого процесса в зависимости от локализации проникающего склерального ранения (экспериментальное исследование): Автореф. дис. … канд. мед. наук. СПб., 2001.-16с.
к содержанию опубликовать статью
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ОРБИТАЛЬНЫХ ПЕРЕЛОМОВ С ПРИМЕНЕНИЕМ РАЗЛИЧНЫХ МАТЕРИАЛОВ
Сироткина И.А., Бухарина Е.С., Муняев В.В.
Центр неотложных состояний и травм органа зрения, Городской центр врожденных и приобретенных дефектов и деформаций челюстно-лицевой области, ГБУЗ ОКБ №3, г. Челябинск
В работе представлены результаты операций 58 пациентов по восстановлению костных стенок и объема орбиты в разные сроки с применением имплантатов. При первичном восстановлении переломов использовали иммобилизацию перфорированными титановыми пластинами. Поздняя реконструкция проводилась с использованием аллохряща, Аллоплантов, пластмассы. Средний срок наблюдения 4,4 ± 1,2 лет.
Ключевые слова: обширные повреждения склеры, эндовитреальные материалы, первичная хирургическая обработка
Актуальность. В настоящее время возрастает количество повреждений органа зрения и орбитальных структур. Криминальная, автомобильная, также бытовая травма по тяжести приближаются к боевой травме [3,6]. По данным НИИ нейрохирургии им. Н.Н. Бурденко переломы орбиты выявились у 93% пострадавших с краниофасциальными повреждениями [5]. Обширные механические, огнестрельные повреждения глаза и орбиты нередко приводят к значительному функциональному и косметическому дефекту. При повреждении костных стенок орбиты и соединительно тканевых структур, даже без ранения глаза, изменяется топография глазного яблока, что приводит к снижению его функций. Хирургическая иммобилизация отломков костных стенок орбиты в ранние сроки после травмы (до 14 суток) приводит к удовлетворительным функциональным и косметическим результатам. Не диагностированные переломы, позднее обращение пациентов за медицинской помощью, деформация костных структур орбиты, кровоизлияния, контузионные повреждения теноновой капсулы, орбитальной клетчатки приводят к рубцеванию, ущемлению экстраокулярных прямых мышц в рубцах и костных отломках, ограничению подвижности глазного яблока, атрофии орбитальной клетчатки и мышц. В результате развивается мучительная бинокулярная диплопия, эн- или экзофтальм, гипофтальм, вынужденное положение головы, значительный косметический дефект лица. Что оказывает влияние на самочувствие и трудоспособность пациента, способствует развитию травматической оптической нейропатии, приводящей к выраженному снижению и даже утрате зрительных функций на стороне повреждения при неповрежденном глазном яблоке.
Задачей восстановительной хирургии орбиты является устранение посттравматических дефектов и деформаций костных стенок орбиты, сохранение максимально возможных зрительных функций на стороне повреждения.
Трудности реконструктивной хирургии орбиты определяются многоплановостью вмешательств, требующих восстановления анатомических образований, необходимостью заполнения дефицита тканей инертным, биосовместимым, не вызывающим агрессивного рубцевания трансплантатом и восстановлением различных по своей структуре тканей.
Возникает необходимость комбинированного применения различных пластических материалов:, алло- и эксплантатов, аутотрансплантатов с эксплантатами [1,2,5,6]. Однако актуален и не решен вопрос выбора оптимального, отвечающего всем требованиям офтальмопластики трансплантационного материала.
Цель работы: изучение результатов первичной и поздней хирургической реабилитации пациентов с травматическим повреждением костных стенок орбиты с применением различных материалов.
Материалы и методы: Из общего числа пациентов с переломами стенок орбиты, оперированных в ГБУЗ ОКБ №3 г. Челябинска с 2006-2013 г. отобрано 58 пациентов 12 – 71 лет (мужчин – 52, женщин – 6) с повреждением костных стенок орбиты. Причиной травм явилось межличностное насилие – у 23 (34,2%) пациентов, дорожно-транспортное происшествие – 20 (26,3%), спортивная травма – 3 (7,9%), бытовая травма – 3 (7,9%).
В связи с тем, что обычная рентгенография позволяет выявить перелом стенок орбиты только в 70% случаев [4] по сравнению с компьютерной томографией нами для диагностики использованы компьютерная томография – КТ (CT MAX – 640 GE), спиральная компьютерная томография (GE Light Speed 16-ct). Исследование состояния глаз, кроме стандартных офтальмологических методов, проводили с помощью двухмерной эхографии (A-B Scan Humphrey 840); ультразвуковой допплерографии сосудов орбиты (Aloka 2000).
Изолированный «взрывной» перелом нижней стенки орбиты диагностирован у 3 (7,9%) пациентов, перелом скуло-орбитального комплекса – 32 (57,9%). У 23 (34,2%) – обнаружено повреждение более 2 стенок. Часть хирургических вмешательств выполняли совместно с: нейрохирургом, челюстно-лицевым хирургом, оториноларингологом.
Реконструктивные операции были выполнены в различные сроки (от нескольких часов до 1 года после травмы). В связи наличием дефицита мягких тканей и костных стенок орбиты из-за многооскольчатых переломов, кроме наложения традиционных костных швов возникала необходимость в использовании дополнительных имплантатов. Все пациенты разделены на группы по локализации перелома, срокам выполнения оперативного вмешательства и виду используемого имплантационного материала для операций.
При первичной реконструкции (в сроки от 12 часов до 3 недель после травмы) 28 (48,27%) пациентам иммобилизацию костных отломков проводили с применением перфорированных титановых пластин, 1 (2,6%) – с использованием биоматериала Аллоплант (производства ВЦГиПХ г. Уфа). Поздняя реконструкция (в сроки от 1,5 месяцев до года) проводилась 30 (51,7%) пациентам. 8 (26,4%) из 28 пациентам при операции использовали аллотранспланты, произведенные тканевой лабораторией г. Челябинска (консервированный аллохрящ и декальцинированная кость); 27 (63,3%) пациентам реконструкция была выполнена с использованием биоматериалов серии Аллоплант. В этой группе первичная реконструкция не произведена по разным причинам: недиагностированные переломы, позднее обращение пациентов за медицинской помощью, невозможность первичной операции из-за тяжести общего состояния при сочетанной травме. 3 (10%) пациентам при посттравматическом анофтальме сочетанном с переломами костных стенок орбиты проведена реконструкция нижней стенки в 2 случаях, верхней в 1 случае с использованием самоотвердевающей пластмассы «Протакрил» и одновременное формирование опорно-двигательной культи Аллоплантом.
У 55 (92,1%) пациентов использовали транскутанный доступ. У 3 (7,9%) пациентов выбрали трансконъюнктивальный доступ. При доступе к нижней стенке орбиты, 37 (71%) случаев, разрез проводили параллельно нижнему ресничному краю с продолжением по средней височной складке (как при эстетической нижней блефаропластке) и отсепаровкой кожно-мышечного лоскута до нижне-орбитального края. Такой оперативный доступ, по нашим наблюдениям, позволяет избежать длительного послеоперационного лимфостаза, который сопровождает послеоперационный период при разрезе кожи в проекции нижнего края орбиты. При необходимости доступа к внутренней стенке и слезному мешку разрез продолжали вверх по медиальной спайке у 2 (5,3%). У 3 (7,9%) пациентов при доступе к верхней стенке орбиты использовали фронто-височный доступ. Доступ к верхней стенке орбиты был осуществлен по посттравматическому рубцу с одновременным исправлением рубцовой деформации верхнего века – 3 (7,9%).
При использовании аллохряща и декальцинированной кости вкладывали несколько фрагментов биоматериалов. Биоматериал Аллоплант для пластики орбиты использовали в собственном варианте или в виде дубликатуры в зависимости от степени недостающего объема. Формирование орбитального края из пластмассы проводили инраоперационно по слепку имеющегося костного дефекта. Титановые пластины фиксировали шурупами в зоне дефекта. Аллотрансплантаты помещали поднадкостнично, ушивая ее аллосухожильными швами серии Аллоплант.
Результаты и обсуждение. Послеоперационные результаты оценивали через 1, 6, 12 и более месяцев после операции при сравнении данных измерения линейных показателей глазных щелей, экзофтальмометрии с измерением этих же величин на фотографиях: оценивали удовлетворенность пациента результатами операции. Для оценки функциональных результатов проводили стандартное офтальмологическое обследование.
Средний срок наблюдения 2,4 ± 1,2 лет.
Клинический и функциональный результат расценен как удовлетворительный у 52 (84,2%) пациентов: глазное яблоко на стороне травмы располагалось на одном уровне с контралатеральным, энофтальм уменьшился в среднем на 3 мм, экзофтальм исчез полностью, птоз 1 степени сохранялся у одного пациента, западание верхнего века уменьшилось у всех пациентов. У 25 (65,%) пациентов бинокулярная диплопия устранена полностью, у 5 сохранялось в крайних позициях взгляда. Неудовлетворительный результат в сроки наблюдения 1 - 6 месяцев получен у 6 (15,8%) пациентов. У 5 из них (все были прооперированы с применением аллохряща производства тканевой лаборатории г. Челябинска) сохранялась бинокулярная диплопия, энофтальм более 4 мм, у одного - птоз верхнего века 2 степени, у одного пациента прогрессировала травматическая оптическая нейропатия, у одной пациентки произошла миграция хрящевого имплантата кпереди, что создало новый функциональный и косметический дефект, потребовало повторной хирургической коррекции. Через полгода после первой операции 3 пациентам были проведены реоперации на орбите с применением биоматериала «Аллоплант». У пациента с прогрессирующей травматической оптической нейропатией после разделения сращений эстраокулярных мышц с глазным яблоком и надкостницей в ретробульбарное пространство (в мышечную воронку) ввели Аллоплант для пластики объемных дефектов с отверстием для зрительного нерва до нормального положения глазного яблока. В результате удалось избавить пациента от мучительной бинокулярной диплопии, вынужденного положения головы; значительно (на 20%) повысить зрительные функции на стороне повреждения. У пациентки с мигрирующими кусочками хряща проведена его замена на Аллоплант для пластики орбиты до полной коррекции гипофтальма. У одной пациентки, прооперированной через 2 недели после травмы при переломе нижней стенки орбиты в задней трети не удалось полностью освободить разволокненную нижнюю прямую мышцу из зоны перелома, что потребовало (через 6 месяцев) повторной операции на экстраокулярных мышцах. Один пациент не явился на повторную операцию. У одной пациентки с переломом скулоорбитального комплекса, прооперированной через 3 недели после травмы, на второй день после операции развилась острая ишемическая нейропатия зрительного нерва с последующим амаврозом на стороне травмы.
Заключение Использование современных методов исследования КТ, спиральной компьютерной томографии при диагностике переломов стенок орбиты позволяет визуализировать повреждения и точнее определить тактику оперативного вмешательства. Участие в операции специалистов разных профилей, использование биосовместимых имплантатов позволяет получить удовлетворительные результаты в 84,2%. Лучший функциональный и косметический эффект достигается при первичной фиксации костных отломков титановыми пластинами. При поздних реконструктивных операциях удовлетворительные стабильные результаты получены при применении биоматериалов Аллоплант (производства ВЦГиПХ г. Уфа). При сочетании перелома стенок орбиты с анофтальмом удовлетворительный результат получен при реконструкции костных стенок с использованием самоотвердевающей пластмассы «Протакрил» и одновременной имплантации опорно-двигательной культи из Аллопланта.
Литература
- Груша Я.О. Некоторые аспекты биоинтеграции пористых орбитальных имплантатов / Я.О. Груша, А.А.Федоров, Х.Хосейн Пур // Заболевания опухоли и травматические повреждения орбиты, Сб. научн. Трудов – М.- 2005 – С.243-245.
- Давыдов Д.В. Разработка и особенности применения композитных гидрогелевых имплантатов в реконструктивной хирургии орбиты / Д.В.Давыдов, Н.Е.Кравченко, И.В.Решетов с соавт. // Заболевания опухоли и травматические повреждения орбиты, Сб. научн. Трудов – М.- 2005 – С.245-250.
- Даниличев В.Ф., Современная офтальмология // С.-П.- Питер - – 2000 – 667с.
- Катаев М.Г., Диагностика и тактика лечение при переломах орбиты / М.Г. Катаев, С.А. Еолчиян, А.П. Тишкова // Вестн. офтальмол. – 2006. - №1. - С.26-32.
- Потапов А.А., Доказательная нейротравматология / А.А. Потапов, Л.Б. Лихтерман, В.Л. Зельман, В.Н. Корниенко, А.Д. Кравчук // Москва – 2003 – 556с.
- Филатова И.А., Компьютерная томография в диагностике и определении тактики лечения у пациентов с посттравматической патологией глаза и орбиты / И.А.Филатова, А.П.Тишкова, М.Б.Берая и др. // Вестн. офтальмол. – 2005. - №6. - С.9-14.
к содержанию опубликовать статью
ОПЫТ ЗАКРЫТИЯ ДЕФЕКТА КОНЪЮНКТИВЫ В ОБЛАСТИ ФИЛЬТРАЦИОННОЙ ПОДУШКИ ПОСЛЕ АНТИГЛАУКОМНОЙ ОПЕРАЦИИ
А. В. Агафонов, Т. В. Анафьянова, Л. А. Карамчакова
Отделение микрохирургии глаза ГБУЗ РХ «Республиканская клиническая офтальмологическая больница им. Н.М. Одежкина», Республика Хакасия, г. Абакан
Современная регенеративная медицина показала свою высокую эффективность в самых различных областях клинической практики и в частности в офтальмологии на основе биоматериалов «Аллоплант» [1, 2]. В условиях нашей клиники с 2004 года с применением биоматериалов серии Аллоплант (БМА) проведено около тысячи операций при лечении осложненных случаев прогрессирующей близорукости, амблиопии тяжелой степени и атрофии зрительного нерва, птоза верхнего века, ретинопатии различного генеза, субатрофии глазного яблока, пигментной дистрофии сетчатки, первичной глаукоме, язв роговицы, ноовообразований конъюнктивы, отслоек сетчатки.
Ключевые слова: закрытие дефекта конъюнктивы, пластика фильтрационной подушки, Аллоплант, антиглаукоматозная операция
Применение технологии БМА в оперативном лечении чаще использовалось при язве роговицы с большой площадью дефекта тканей от 33,3 % до 100,0 % случаев (рис.1)во всех случаях достигнута хорошая адаптация трансплантата и ареактивное течение послеоперационного периода.
| Рис.1. Динамика применения БМА при операциях с большой площадью дефекта роговицы (2004-2014 гг.) |
В отдельных случаях БМА используется как метод минимизации ранних осложнений после проведенны антиглаукомных операций: закрытие послеоперационного дефекта конъюнктивы, восстановление фильтрационной подушки, профилактика грубого рубцевания в зоне операции. Опыт использования БМА в раннем послеоперационном периоде представлен в описании клинического случая закрытия дефекта слизистой оболочки в области фильтрационной подушки после антиглаукомной операции.
Клинический случай.
Пациент А., 80 лет, поступил в плановом порядке в офтальмологическое отделение «Микрохирургия глаза» Республиканской клинической офтальмологической больницы им. Н.М. Одежкина.с диагнозом: первичная открытоугольная 3 «в» глаукома левого глаза, 3 «а» - правого глаза.
Из анамнеза: наблюдается с диагнозом глаукома с 2005 года, ранее не оперирован. Ежегодно получает нейропротекторное лечение, в том числе гипотензивную терапию на левый глаз (дорзопт и тимолол). Острота зрения при поступлении 0,01/0,15 н.к., внутриглазное давление 21/30 мм.рт.ст. В динамике за последний год острота зрении на левый глаз ухудшилась с 0,3 до 0,15,а поля зрения - с 50-30 градусов по Гольдману до 30 – 0`.Пороги электрической чувствительности и лабильности составили 290мкА/35Гц. на левом глазу.
Проведена операция непроникающая глубокая склерэктомия (НГСЭ) для снижения внутриглазного давления на левом глазу по стандартной технологии, с предварительной профилактической задней трепанацией склеры. Разрез конъюнктивы линейный, параллельно лимбу, в 5 мм от последнего. Теноновая оболочка и конъюнктива в конце ушиты послойно. С первого дня после операции определялась плоская фильтрационная подушка, гипотония, складчатость десцеметовой оболочки роговицы.
Через неделю после операции достоверно определялась экзофильтрация внутриглазной жидкости и диастаз послеоперационной раны конъюнктивы. В связи с формированием дефекта конъюнктивы в области вмешательства было решено произвести пластику фильтрационной подушки с применением БМА для пластики конъюнктивы. С этой целью на зону операции был уложен, расправлен и фиксирован вышеуказанный Аллоплант. Конъюнктива ушита узловыми швами.
В раннем послеоперационном периоде пациент предъявлял жалобы на чувство инородного тела в оперированном глазу. При осмотре наблюдалась незначительная инъекция коньюнктивы глазного яблока, под которой просматривался Аллоплант для пластики коньюктивы. Фильтрационной подушка разлитая, передняя камера равномерная, влага прозрачная. Пальпаторно Т(-0,5).
На 5-й день после операции острота зрения повысилась с 0,1 до 0,15 н.к. Объективно –глаз успокаивается, конъюнктивальные швы состоятельные, фильтрационная подушка умеренно разлитая,роговица прозрачная, передняя камера средней глубины, влага прозрачная. зрачок круглый. Офтальотонус составил 19мм рт.ст.
При выписке: поля зрения оперированного глаза расширились 30 градусов до 50-60 по Гольдману, пороги электрической чувствительности и лабильности составили 300мкА/41 Гц.
Осмотр пациента через 2 месяца после операции: острота зрения левого глаза составила 0,1н.к, глаз спокойный, фильтрационная подушка выраженная, разлитая, БМА под конъюнктивой визуализируется слабо. Роговица прозрачная, передняя камера средней глубины, влага прозрачная. Офтальмотонус составил 17 мм рт.ст.
Заключение.
Применение в более ранние сроки БМА при осложненном послеоперационном течении после антиглаукомных вмешательств позволяет достичь устранения дефекта операционной зоны и формирования состоятельной фильтрационной подушки с сохранением зрительных функций.
В практике микрохирургических офтальмологических отделений следует широко применять технологию БМА для достижения благоприятных результатов в оперативном лечении глаукомы и при реконструктивных операциях на конъюнктиве глаза.
ЛИТЕРАТУРА
- Воеводкина Е. В., Собянин Н. А., Крылова О. В., Садиков Ю. А. Использование роговичного биоматериала Аллоплант в лечении асептических изъявлений роговицы с органосохранной целью на слепых глазах // Сб. матер. V Российского общенационального офтальмологического форума. - М., 2012. - Т. 1, С. 158-159.
- Трансплантационные технологии аллоплант в офтальмохирургии / Э. Р. Мулдашев, Р. Т. Нигматуллин, А. Ю. Салихов [и др.] // Проблемы современной офтальмологии: сб. науч. тр., посвящ. 100-летию клиники глазных болезней Казань, гос. мед. университета. - Казань, 2000. - С. 175-179.
к содержанию опубликовать статью
ВНЕДРЕНИЕ СОВРЕМЕННОЙ ВЫСОКОТЕХНОЛОГИЧНОЙ МЕТОДИКИ – РАДИОВОЛНОВОЙ ХИРУРГИИ – В ПЛАСТИЧЕСКОЙ ОФТАЛЬМОХИРУРГИИ
Филатова И.А.
ФГБУ «МНИИ глазных болезней им. Гельмгольца» Минздрава России, г. Москва
Совершенствование применяемых технологий в диагностике и хирургическом лечении способствует повышению эффективности в реабилитации пациентов. При выполнении реконструктивных операций у пациентов с последствиями травм, врожденной и сенильной патологией, а также с исходами неоднократных оперативных вмешательств основной задачей является достижение щадящего разреза, тщательного гемостаза, минимального повреждения окружающих тканей, снижения отека и послеоперационной воспалительной реакции. С этой целью используют электро- и диатермокоагуляторы. Новой современной технологией, по сравнению с электрохирургией и диатермокоагуляцией, является радиоволновая хирургия. Хирургический прибор «Сургитрон» Ellman SURGITRON (USA), основанный на принципах воздействия радиоволны на ткани, нашел широкое применение в различных областях хирургии. Мы внедрили данную современную технологию в особом разделе офтальмологии – пластической офтальмохирургии.
Ключевые слова: радиоволновая хирургия, пластическая офтальмохирургия
Цель работ: оценка эффективности метода радиоволновой хирургии при реконструктивных операциях на веках и периорбитальных тканях.
Материалы и методы. Проведен анализ результатов применения метода радиоволновой хирургии в течение 17 лет в группе пациентов, которым выполняли реконструктивные операции на придаточном аппарате глаза (веки и периорбитальные ткани) в отделе травматологии, реконструктивной хирургии и глазного протезирования НИИ глазных болезней им. Гельмгольца. Клиническую группу составили 2275 пациентов с патологией придаточного аппарата глаза. В указанной группе больных были выполнены следующие виды операций: устранение птоза верхних век (врожденного, сенильного, посттравматического, постоперационного) – 469, коррекция эпикантусов – 71, устранение заворота век – 91, устранение выворота век – 69, эвисцерация – 473, реконструкция век – 729, дакриоцисториностомия – 57, экстирпация слезного мешка и вскрытие абсцесса слезного мешка – 66, пластика орбиты – 71, реконструкция конъюнктивальной полости – 117, реконструкция культи – 30, удаление кисты – 25, удаление инородных тел орбиты – 7. Возраст пациентов варьировал от 4 до 93 лет (m = 39 ± 7,7). В исследуемой группе мужчин было 1414, женщин – 861. У 39% пациентов операции были повторными, а в 9,3% случаев в анамнезе было указано до 4-5 хирургических вмешательств.
Всем пациентам оперативное лечение произведено с использованием прибора для высокочастотной радиоволновой хирургии «Сургитрон™» (Elman, USA), который работает с частотой (3,8 – 4,0 МГц), входящей в диапазон коротких волн. Радиочастотный хирургический прибор имеет три режима работы: микроразрез, разрез + коагуляция, коагуляция + деструкция. Кроме того, имеется набор сменных наконечников для различных манипуляций (игольчатый, остроконечный, тупоконечный, шариковый, петля), включая пинцет для биполярной коагуляции.
Послеоперационный период наблюдения составил от 3 месяцев до 17 лет (m = 9,3 ± 2,3).
Результаты и обсуждение. При реконструктивных вмешательствах на рубцовых деформациях после травм и ожогов применение прибора «Сургитрон» способствует минимализации кровотечения, что особенно актуально при повторных операциях после серии ранее проведенных пересадок тканей, спаянных с подлежащими тканями рубцах, а также при наиболее «кровавых» операциях, таких как дакриоцисториностомия и дакриоцистэктомия. При выполнении разрезов кожи, подсепаровки кожи, разделении глублежащих тканей и рубцов в режиме «разрез-коагуляция» с мощностью 15-23 Вт облегчается визуализация всех анатомических структур век, что создает значительный комфорт во время хирургических манипуляций. Одним из преимуществ радиоволновой хирургии является то, что значительно сокращается время операции, поскольку исключается ранее отнимавший большой процент оперативного времени этап тампонирования раны и наложения гемостатических зажимов для обеспечения гемостаза.
При рассечении рубцов и формировании ложа для свободного аутотрансплантата разделение тканей происходило равномерно в одном слое. Выкраиваемые свободные лоскуты (кожи или слизистой) также формировались равномерной толщины за счет работы тонким электродом в одном слое тканей. Данная методика позволяла достичь лучшей адаптации свободного трансплантата ко дну ложа, что в свою очередь способствовало адекватному приживлению и хорошему функциональному результату.
За счет сокращения времени операции и за счет более щадящего влияния на окружающие ткани (без термического повреждения), во время операции и в раннем послеоперационном периоде у пациентов анализируемой группы был менее выраженный отек мягких тканей век и орбиты. Заживление ран кожи и конъюнктивы происходило без осложнений, а после снятия швов отмечали полную адаптацию ран.
Кроме того, в ранние и отдаленные сроки после оперативного лечения в анализируемой группе гнойных осложнений не выявлено. Это достигается в том числе и бактерицидным воздействием радиоволновой частоты. Данная методика особенно актуальна при удалении пиоцеле и вскрытии, санации и дренировании абсцессов (век, слезного мешка). В данных случаях для адекватной коагуляции дна ложа увеличивали мощность до 21-25 Вт и использовали более толстые электроды (например, шариковый).
Во время всех хирургических вмешательств на веках и периорбитальных тканях мы отмечали, что радиохирургический прибор Ellman SURGITRON заменяет собой часть хирургических инструментов, поскольку из операционного набора были исключены скальпели, лезвия, ножницы, гемостатические зажимы, а также сократилось использование материала для гемостаза (салфетки, гемостатическая губка и т.д.).
Радиочастотный хирургический прибор Ellman SURGITRON выгодно отличается от электрохирургических приборов, которые работают на низкой частоте и вызывают более выраженные изменения близлежащих тканей за счет распространения теплового и механического действия волны, а в отличие от лазерных приборов, он портативен (имеет малый вес и объем) и значительно дешевле.
Заключение. При использовании методики радиоволновой хирургии в пластической и реконструктивной офтальмохирургии выявлены следующие преимущества:
- тщательный гемостаз;
- антисептическое воздействие;
- уменьшение отека тканей во время и после операции;
- атравматичное иссечение тканей;
- сокращение времени операции;
- быстрое заживление послеоперационной раны;
- формирование косметического рубца.
Все перечисленные положительные свойства радиоволновой хирургии способствуют повышению эффективности хирургического лечения пациентов с врожденной, сенильной и посттравматической патологией. За счет преимуществ радиоволновой хирургии повышено качество проведения оперативного вмешательства, сокращено время операции и послеоперационного лечения, уменьшено количество осложнений и достигнут лучший косметический эффект.
к содержанию опубликовать статью
ЭКСИМЕРЛАЗЕРНАЯ КОРРЕКЦИЯ ГИПЕРМЕТРОПИИ ПО МЕТОДУ ЛАСЕК
Коротких С.А., Богачев А.Е., Шамкин А.С., Коротких В.С.
Кафедра офтальмологии УГМУ, г. Екатеринбург
Эксимерлазерная коррекция гиперметропии представляет более сложную и трудоемкую задачу, по сравнению с коррекцией миопии [3]. Это связано с более сложным профилем абляции, большей энергетической нагрузкой на роговицу в месте воздействия, располагающегося ближе к периферии роговицы, что определяет вторичность вызываемого оптического эффекта [1,2]. Данные исследований разных авторов отличаются по выбору технологии лазерной коррекции зрения (поверхностная или интрастромальная абляция), ширине зоны абляции, месте центровки абляции и другим параметрам [2].
Ключевые слова: эксимерлазерная коррекция, гиперметропия, ЛАСЕК
Цель: Оценить результаты лазерной коррекции гиперметропии, проведенной на базе медицинской клиники «Профессорская плюс».
Материал и методы: Настоящая работа была выполнена на базе кафедры офтальмологии УГМУ, а также медицинской клиники «Профессорская плюс». С января 2012 года по июнь 2014 года по методу ЛАСЕК было прооперировано 68 пациентов (113 глаз) с диагнозом гиперметропия I-III степени, сложным гиперметропическим астигматизмом. Средний возраст пациентов составил 35±4,6 (от 18 до 58 лет). Диоптрии корригированной гиперметропии составили от 1,25 до 6,5 (в среднем +3,2±0,89 ), корригированного астигматизма - от 0,75 до 4,25 диоптрий (в среднем +2,6±0,54 ). С целью дискретного анализа все пациенты были разделены на три группы по величине сферо-эквивалента (SE), а также была выделена четвертая группа по наличию гиперметропического астигматизма более 2,0 диоптрий (вне зависимости от SE): первая группа- SE до 2,0 диоптрий (28 глаз - 23 пациента), вторая группа- SE от 2,00 до 5,0 диоптрий (53 глаза – 27 пациентов), третья группа -SE более 5, (19 глаз – 11 пациентов), четвертая группа– гиперметропический астигматизм более 2,0 диоптрий, вне зависимости от степени гиперметропии (13 глаз – 7 пациентов).
Для проведения операции использовался эксимерный лазер MEL-80 фирмы Carl Zeiss. Ширина зоны абляции составила 6,0 мм, переходная зона составила 1мм, центровка производилась по центру зрачка. Послеоперационное лечение включало использование защитной мягкой контактной линзы 48-72 часа, антибактериальные, противовоспалительные, кератопротекторные местные лекарственные препараты. После завершения основного курса лечения пациенту рекомендовалось в течение 6 месяцев закапывать увлажняющие капли на основе гиалуроновой кислоты.
Результаты и их обсуждение. Лазерная коррекция гиперметропии является наиболее успешной при гиперметропии 1 и 2 степеней, поскольку позволила добиться целевой рефракции (±0,50) в 84% случаев в первой группе и в 73% второй группе. Потеря строк МКОЗ наблюдалась у ряда пациентов во второй, третьей, четвертой группах и составила не более 2 строк, что может быть связано с увеличенным углом каппа у пациентов 2 и 3 степени гиперметропии и децентрированной зоной абляции. Частота субэпителиальной фиброплазии в парацентральной зоне роговицы составила 28%, причем максимально была выражена у пациентов третьей и четвертой групп, её расположение соответствовало абляции в слабом меридиане роговицы, что также обусловливало ранний регресс операционного эффекта.
На величины НКОЗ и МКОЗ в третьей и четвертой группах повлияла исходная амблиопия 1 степени, которая наблюдалась на 43% глаз, включенных в эти группы.
После статистической обработки были получены следующие данные (p<0,05): Группа НКОЗ МКОЗ Рефракция (SE) 1 группа (SE≤2,0 дптр) 0,81±0,12 0,93±0,04 ±0,50 - 84% ±1,0 – 12% 2 группа (2 дптр<SE≤5,0 дптр) 0,71±0,08 0,81±0,08 ±0,50 - 73% ±1,0 – 21% 3 группа (SE>5,0 дптр) 0,61±0,11 0,72±0,13 ±0,50 – 54% ±1,0 – 17% 4 группа (ast>2,0, SE-любое) 0,59±0,14 0,68±0,18 ±0,50 – 51% ±1,0 – 13% НКОЗ – некорригированная острота зрения МКОЗ – максимально корригированная острота зрения.
Выводы.
1. Эксимерлазерная коррекция гиперметропии по методу ЛАСЕК является хорошим и предсказуемым методом хирургического лечения гиперметропии первой и второй степени (SE до 5 диоптрий, гиперметропический астигматизм до 2 диоптрий).
2. При гиперметропии 3 степени, а также величине гиперметропического астигматизма более 2 диоптрий лазерная коррекция зрения имеет ограниченные возможности, из чего следует, что у этих пациентов нужно также рассматривать другие методы хирургического лечения, например, внутриглазные рефракционные операции (факичные ИОЛ, аспирация прозрачного хрусталика и имплантация ИОЛ).
3. Требуется дальнейшее изучение оптимальных параметров диаметра абляции, его центровки, введения поправочных коэффициентов, оценки стабильности операционного эффекта и других путей повышения эффективности эксимерлазерной коррекции гиперметропии.
Список литературы
- Л.И.Балашевич «Хирургическая коррекция аномалий аккомодации и рефракции» СПб.:Человек, 2009 – 296с.,ил.
- Куликова И.Л., Паштаев Н.П., «Кераторефракционная лазерная хирургия в реабилитации детей и подростков с гиперметропической рефракцией». – М: «Офтальмология», 2012.-236с.,ил.
- Аветисов С.Э. «Современные подходы к коррекции рефракционных нарушений»//Вестник офтальмологии.-2006.№1.-С 3-8.
к содержанию опубликовать статью
НОВЫЕ ВОЗМОЖНОСТИ ТЕРАПИИ ВТОРИЧНЫХ ХОРИОРЕТИНАЛЬНЫХ ДИСТРОФИЙ
Хокканен В.М*., Хокканен Валентина Михайловна – профессор кафедры офтальмологии ГБОУ ВПО СЗГУ им.И.И. Мечникова, доктор медицинских наук, профессор. 195196, СПб, Заневский пр.1/82, кафедра офтальмологии СЗГУ им. И.И.Мечникова, тел.(812)3035000, доб.2232; Е-mail: Valentina.Khokkanen@szgmu.ru www.szgmu.ru Карецкий А.В.**,Карецкий Андрей Валентинович – и.о. руководителя отделения фтизиоофтальмологии ФГУ СПбНИИФ МЗ РФ, кандидат медицинских наук Лопатина Е.В.*** Лопатина Екатерина Валентиновна - ведущий научный сотрудник отдела экспериментальной физиологии и фармакологии ФМИЦ им. В.А. Алмазова МЗ СР; лаборатории физиологии возбудимых мембран Института физиологии им. И.П.Павлова РАН, доктор биологических наук
*ГБОУ ВПО СЗГМУ им. И.И. Мечникова МЗ РФ, Санк-Петербург
**ФГУ СПбНИИФ МЗ РФ, Санк-Петербург
***Институт физиологии РАН им. И.П. Павлова, Россия;
***ФГБУ «Федеральный медицинский исследовательский центр
им. В.А. Алмазова» МЗ РФ, Санк-Петербург
В статье представлены результаты экспериментов действия препарата «Аноцептин» в органотипической культуре сетчатки куриных эмбрионов и на модели туберкулезного хориоретинита у кроликов. Доказана положительная роль препарата «Аноцептин» по сохранению клеток пигментного эпителия сетчатки даже в случае такого деструктивного заболевания как туберкулез глаз. Учитывая, что поражение пигментного эпителия сетчатки является одной из главных патогенетических причин дистрофических заболеваний сетчатки и хориоидеи, применение препарата «Аноцептин» может предотвращать их возникновение.
Ключевые слова: пигментный эпителий сетчатки, вторичная дистрофия, осложнения хориоретинита, туберкулёз глаз, аноцептин, коменовая кислота
Актуальность. Причины развития вторичной поствоспалительной хориоретинальной дистрофии многообразны. В первую очередь изменения на глазном дне возникают вследствие отека в перифокальной области и связанной с этим гипоксией клеток, к которой, как производная нервной ткани, очень чувствительна ткань сетчатки.
Гистологические исследования показали, что в очаге воспаления и прилегающей к ней области в хориоидее и сетчатке многие сосуды находятся в разрушенном состоянии. Часто возникают ретинальные геморрагии и кровоизлияния в стекловидное тело. Повреждение мембран эритроцитов приводит к гемолизу, распаду гемоглобина и накоплению большого количества ионов железа. Образующиеся при этом гидроксильные свободные радикалы оказывают повреждающее действие на окружающие ткани, особенно на сетчатку [4]. Новообразованные сосуды, в свою очередь, прорастают сквозь мембрану Бруха под пигментный эпителий либо через дефекты пигментного эпителия, отслаивая его вместе с рецепторным слоем. Все это создает предпосылки к возникновению различных осложнений, в частности – хориоретинальной дистрофии. Возникающие дефекты в пигментном эпителии сетчатки провоцируют нарушение его функций: барьерной, транспортной, абсорбции световой энергии, фагоцитоза наружных сегментов фоторецепторов, метаболизм витамина А [2,6]. Поэтому поиск препаратов, способных защитить ткани сетчатки от негативных воздействий эндогенной и экзогенной природы, направленных на предупреждение возникновения вторичных дистрофических изменений, является актуальным и обоснованным.
Цель исследования.Изучить влияние препарата «Аноцептин» на ткань сетчатки, в органотипической культуре и оценить перспективы его использования для профилактики вторичной постувеальной дисторфии.
Материал и методы. В органотипической культуре ткани и модели экспериментального туберкулезного хориоретинита изучено действие оригинального лекарственного препарата «Аноцептин», созданного специалистами Института физиологии им. И. П. Павлова РАН. Действующей субстанцией препарата является производная гамма-пирона коменовая кислота, получаемая путем прямого химического синтеза (разрешение Федеральной службы по надзору в сфере здравоохранения и социального развития N 158 от 3 мая 2007 года).
Объектом исследования в данной части работы являлись 500 эксплантатов ткани сетчатки 10-12-дневных куриных эмбрионов. Для визуализации эксплантатов использовали микротеленасадку для микроскопа (серия 10, МТН-13 «Альфа-Телеком», Россия).
Количественную оценку роста эксплантатов ткани сетчатки 10-12-дневных куриных эмбрионов осуществляли с помощью пакета программ PhotoM. Для количественной оценки влияния исследуемых веществ использовали морфометрический метод, с расчетом индекса площади (ИП).
Нейротрофические, ретинопротекторные и противовоспалительные свойства препарата «Аноцептин» исследовали на модели туберкулезного очагового хориоретинита. Операцию моделирования туберкулезного хориоретинита проводили на 40 глазах 20 половозрелых самцов кроликов по методике, разработанной Э.Н. Беллендиром и соавт. в 1971. После формирования хориоретинального очага проводили противотуберкулезную терапию (ПТТ) до стабилизации процесса по стандартной схеме [5].
До начала эксперимента животные были разделены на основную и контрольную серии. В основную серию вошли 10 кроликов (20 глаз), контрольную серию составили 10 кроликов (20 глаз).
Результаты и обсуждение. Препарат «Аноцептин» добавляли в питательную среду в концентрациях: 10-6 М, 10-7 М, 10-8 М, 10-10 М (в пересчете на действующую субстанцию – коменовую кислоту). Контрольное значение ИП принимали за 100%, достоверность различий в ИП оценивали с помощью t- критерия Стъюдента.
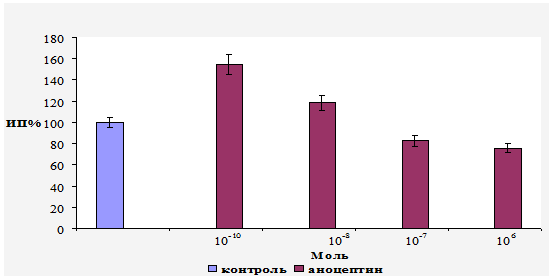 |
| Рис. 1 Влияние «Аноцептина» на рост эксплантатов ткани сетчатки 10-12-дневных куриных эмбрионов - трое суток культивирования. (По оси абсцисс – концентрация, М; По оси ординат – индекс площади эксплантатов (ИП, %). * - p<0.05) |
Контролем служили эксплантаты, культивируемые только в условиях питательной среды.
При введении в питательную среду препарата «Аноцептин» (10-6 М) наблюдали достоверное угнетение роста эксплантатов ткани сетчатки на 24±2% (n=25; p<0.05) по сравнению с контролем (n=25). В концентрации 10-7 М препарат «Аноцептин» незначительно угнетал рост эксплантатов ткани сетчатки. ИП эксплантатов был ниже контрольного значения на 17,5±2% (n=27). Добавление в культуральную среду препарата в концентрации 10-8 М приводило к достоверной стимуляции роста эксплантатов ткани сетчатки на 18±2% (n=25; p<0.05) по сравнению с контролем (n=25). При введении в питательную среду препарата в концентрации 10-10М наблюдали стимуляцию роста эксплантатов ткани сетчатки (рис.1). ИП был достоверно выше контрольного значения на 50% (n=25; p<0.05).
Таким образом, впервые было обнаружено дозозависимое действие препарата «Аноцептин» по отношению к регуляции роста эксплантатов ткани сетчатки 10-12 дневных куриных эмбрионов. На фиксированных препаратах, окрашенных гематоксилином и эозином, обнаружено, что зону роста контрольных и экспериментальных эксплантатов ткани сетчатки составляли клетки пигментного эпителия, ганглиозные клетки, палочки, колбочки.
При изучении анальгетических и противовоспалительных свойств «Аноцептина» было обнаружено, что его основной компонент - коменовая кислота модулирует ноцицептивный сигнал за счет активации трансдукторной функции Na/ K-АТФазы мембраны сенсорного нейрона. В качестве трансдуктора сигнала Na/ K-АТФаза, принимает участие в регуляции внутриклеточной сигнализации, роста и пролиферации клеток тканей разного типа [1,3,7]. Полученные экспериментальные данные позволили заключить, что в основе механизма нейротрофического действия препарата «Аноцептин» на клетки ткани сетчатки лежит его способность регулировать трансдукторную функцию Na/K-АТФазы. Действие «Аноцептина» является дозозависимым и в концентрации 10-10М происходит наиболее выраженная стимуляция роста эксплантатов ткани сетчатки (рис.1).
В экспериментах in vivo на модели туберкулезного хориоретинита было изучено влияние препарата «Аноцептин» на течение специфического процесса при парабульбарном введении. Эффективность лечения оценивали по офтальмоскопическим признакам и гистологической картине.
Местного раздражающего действия препарата при его парабульбарном введении не обнаружено. Изменения на глазном дне и в параорбитальной клетчатке отсутствовали. Последнее свидетельствует о безопасности применения препарата «Аноцептин» при таком способе введения.
Влияние препарата «Аноцептин» на течение туберкулезного хориоретинита исследовали у 10 кроликов (20 глаз). Полученные сведения сравнивали с контрольной серией животных, где проводилась лишь стандартная ПТТ.
В обеих сериях животных наблюдали положительную динамику лечения туберкулезных хориоретинитов. Однако, результаты лечения экспериментальных животных основной серии, которые наряду со стандартной ПТТ получали в течение 10 дней 0,5 мл 2% раствора препарата «Аноцептин» парабульбарно превосходили таковые у животных контрольной серии.
Присоединение «Аноцептина» к ПТТ экспериментального туберкулезного хориоретинита (рис.2) способствовало положительной динамике офтальмоскопических показателей (размер очага - d, уровень проминенции - h, экссудации - e).
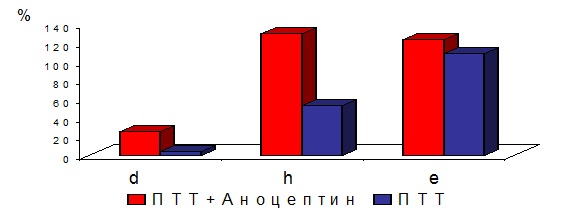 |
| Рис. 2. Эффективность проводимой терапии в основной и контрольной сериях исследования. *p<0,01 d - размер очага; h - уровень проминенции (выстояние); e - экссудация |
Так, средний суммарный прирост эффективности лечения туберкулезного хориоретинита по трем тестируемым параметрам за счет применения «Аноцептина» составил 37,7%. Результативность терапии в основной серии по отношению к размеру очага, уровню проминенции, экссудации была на 21%, 77% и 15 % выше, чем в контроле (р < 0,01 ).
В ходе гистологических исследований тканей глазного дна кроликов установлено, что у животных, получавших дополнительно «Аноцептин» на фоне этиотропной терапии (рис.3), удалось сохранить пигментный эпителий сетчатки не только в перифокальной зоне (90%), но и на периферии очага (33%). В контрольной серии, где проводилась только ПТТ, пигментный эпителий был почти полностью разрушен (рис.4).
 |
| Рис.3 Гистологический препарат глазного дна кролика на фоне парабульбарного применения 2% раствора «Аноцептина» (х 100) |
 |
| Рис.4 Гистологический препарат глазного дна кролика на фоне применения только ПТТ (х 100) |
Заключение. Полученные данные свидетельствуют об эффективности использования препарата «Аноцептин» в комплексной терапии экспериментального туберкулезного хориоретинита, главным образом за счет сохранения клеток пигментного эпителия, не только в перифокальной зоне, но и по периферии очага. Это позволит избежать таких осложнений как отслойка пигментного и нейроэпителия сетчатки, хориоидальной неоваскляризации, и как следствия - формирования обширных зон вторичной дистрофии сетчатки.
Результаты проведенных исследований позволяют рекомендовать препарат «Аноцептин» для дальнейших экспериментальных исследований в офтальмологии при лечении другой патологии глаз и использования при проведении второй и третьей фаз клинических испытании, как во фтизиатрии, так и в офтальмологии.
Работа поддержана грантом РНФ № 14-15-00677.
Список литературы
- Лопатина Е.В., Пеннияйнен В.А., Зайка А.А. Исследование участия Na/K –АТФазы в регуляции роста эксплантатов ткани сердца в органотипической культуре // Бюл.эксперим.биол. мед.2005.Т.140, №8.С.150-152.
- Миронова Э.М. Роль пигментного эпителия и взаимодействующих с ним структур в патогенезе глазных заболеваний: Автореф. дис. …д-ра биол. наук. – М., 1990.
- Пеннияйнен В.А., Лопатина Е.В. Исследование роли Na/K-АТФазы в регуляции роста нейритов сенсорных нейронов // Бюл. эксперим. биол.мед. 2005.Т.139, №2. С.157-159.
- Полунин Г.С., Воробьева О.К. Современные подходы к комплексному лечению хориоретинитов различной этиологии // Клин. офтальмол. – 2002. – Т. 3, № 1. – С. 16-18.
- Хокканен В.М. Особенности клиники, диагностики и лечения туберкулеза глаз в современных социальных и эпидемиологических условиях: Автореф. дис. д-ра мед. наук. - СПб., 1999 – 27с.
- Хокканен В.М. Туберкулез глаз // Фтизиатрия: национальное рук-во под ред. М.И. перельмана.- М: ГЕОТАР-МЕДИА, 2007. – С. 331-335
- Xie Z.Ouabain interaction with cardiac Na/K-ATPase reveals that the enzyme can act as a pump and as a signal transducer // Cell Mol. Biol., 2001, v. 47, p. 383-390.
к содержанию опубликовать статью
ОПТИЧЕСКАЯ КОГЕРЕНТНАЯ ТОМОГРАФИЯ В ПРИНЯТИИ РЕШЕНИЙ ПРИ ИМПЛАНТАЦИИ СОСУДИСТЫХ РАССАСЫВАЮЩИХСЯ КАРКАСОВ И ОЦЕНКЕ РЕГЕНЕРАЦИИ
У БОЛЬНЫХ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
В. В. Плечев, д.м.н., профессор зав. кафедрой госпитальной хирургии БГМУ И. Е. Николаева, Главный врач Республиканского Кардиологического Центра, к.м.н. И. Г. Загитов,врач по рентгенэндоваскулярным диагностике и лечению, отделения РХМДИЛ № 1, РКЦ И. В. Бузаев, к.м.н., зав. отделением Рентгенхирургических методов диагностики и лечения № 1, Республиканского Кардологического Центра И. Е. Яманаева к.м.н., кариолог, отделения РХМДИЛ № 1, РКЦ Султанов Б. М.врач-анестезиолог отделения РХМДИЛ № 1, РКЦ
Отделение РХМДИЛ № 1, Республиканский Кардиологический Центр, г. Уфа
С возрастающим числом имплантируемых скафолдов, имплантируемых биорезорбируемых внутрисосудистых каркасов (BVS), важно понимать особенности их раскрытия, для того чтобы добиться оптимального результата. Оптическая когерентная томография (ОСТ) - важный инструмент диагностики внутрисосудистых повреждений. Целью данного исследования было выявить, влияет ли рутинное использование ОСТ при установке скафолдов на операционную тактику и послеоперационный результат.
За период 2014-2015 гг нами планируется проведение 30 стентирований с применением рассасывающихся внутрисосудистых каркасов (Absorb, Abbott Vascular), с последующей визуализацией и оценкой ОСТ. В контрольной группе, скафлоды установлены при традиционной рентген контрастной визуализации. В послеоперационном периоде, через 3 месяца проводится телефонный опрос пациентов по формализованному бланку. Через 12 месяцев – повторная госпитализация с проведением коронарографии и ОСТ.
На текущий момент, проведено 20 имплантаций скафолдов, 10 под ОСТ контролем и 10 без. Было установлено 26 скафлодов, из них 14 в группе с ОСТ и 12 в контрольной группе. В группе с ОСТ в 3-х случаях из 10 были результаты, потребовавшие последующей коррекции. В послеоперационном периоде мы не наблюдали осложнений по конечной точке. Через 3 месяца, нами был проведен телефонный опрос пациентов, с использованием стандартизированного бланка опроса. Из опрошенных 20 пациентов, не было выявлено ни одного результата по конечной точке, ни один пациент не отмечал возобновления болевого синдрома.
Несмотря на свою революционность, метод внутрисосудистой реставрации с применением BVS требует тщательной подготовки и интраоперационного контроля. Даже предварительные результаты нашего исследования говорят о предпочтительности использования методик внутрисосудистой визуализации. Окончательные выводы нашей работы мы планируем представить в конце 2015 года.
Ключевые слова: биорезорбируемые внутрисосудистые каркасы, Абсорб, скафолд, оптическая когерентная томография, ОКТ, ЧКВ, чрескожное коронарное вмешательство, стентирование, bioresorbable vascular scaffolds, BVS, Absorb, optical coherence tomography, ОСТ, primary angioplasty, PCI
Актуальность Появление новейших биорезорбируемых внутрисосудистых каркасов (BVS) в арсенале ренгенхирургии называют началом новой эры в интервенционной кардиологии (Serruys, Garcia-Garcia, & Onuma, 2012). Несмотря на это, BVS так же обладают рядом потенциальных недостатков. Наиболее критичным из них, по нашему мнению, является перелом и миграция страт стента (Ruiz-Salmeron, Pereira, & de Araujo, 2014). Данная проблема особенно актуальна из-за ренгеннегативных свойств скафолдов, что делает их практически невидимыми для интервенционного кардиолога. В связи с все увеличивающимся количеством имплантируемых BVS, возникают вопросы о выборе оптимальной тактики установки скафолдов. Известно, что недораскрытие стентов, малпозиция страт, пролапс тканей через ячейки стентов, приводит к увеличению случаев тромбозов и рестенозов в стенте(Nakamura et al., 1994). Использование внутрисосудистых методов визуализации, в частности внутрисосудистое ультразвуковое исследование, позволяет уменьшить число повторных реваскуляризаций(Casella et al., 2003; Fitzgerald et al., 2000; Oemrawsingh et al., 2003). Появившийся позднее метод оптический когерентной томографии, благодаря высокой разрешающей способности, позволяет с большей точностью выявлять и оценивать такие явления, как краевую диссекцию, тромбоз в стенте, пролапс тканей, перелом и мальпозицию страт (Fujino, Attizzani, et al., 2013; Fujino, Bezerra, et al., 2013; Takarada et al., 2010). Так же, было показано, что использование ОСТ при стентировании улучшает клинический исход (Prati et al., 2012) Перечисленные выше работы проводились с традиционными стентами. Allahwala с соавторами, в журнале Eurointerverntion за 2014 год, указывает, что несмотря на тщательную подготовку предилатацией, точный выбор целевого сосуда, постдилатацию, ОСТ выявляет показания для оптимизации установки скафолда (Allahwala et al., 2014). В данном исследовании мы стремимся установить, влияет ли рутинное использование ОСТ при установке скафлодов на долгосрочный прогноз пациентов.
Цель исследования
Установить, влияет ли рутинное проведение ОСТ во время установки скафолдов на долгосрочный прогноз. В качестве конечной точки была взята совокупность исходов: смерть от сердечных причин, повторная экстренная реваскуляризация в целевой артерии, инфаркт миокарда а так же данные визуализации ОСТ через 12 месяцев после операции - степень отсроченной потери просвета, мм (LLL).
В данном исследовании, предпочтение ОСТ отдавалось как в связи с более высокой разрешающей способностью, так и с большей избирательностью исследования (Brown, McCormick, Hoole, & West, 2013).
Методы За период 2014-2015 гг нами планируется проведение 30 стентирований с применением рассасывающихся внутрисосудистых каркасов (Absorb, Abot Vascular) с последующей визуализацией и оценкой оптической когерентной томографией. В контрольной группе, скафлоды будут установлены без ОСТ, при традиционной рентген контрастной визуализации.
В экспериментальной группе ОСТ проводятся 2-х или 3-х кратно: перед установкой скафолда для точной оценки рефренного диаметра и анатомической допустимости установки скафолда; повторно ОСТ после установки скафолда для оценки качества установки – полноты раскрытия, наличия перелома и миграции страт скафолда, пролапса тканей через решётки стента, наличия тромбоза, диссекции. В случае выявления данных осложнений проводилось их устранение с последующим повторным ОСТ контролем.
Определения Пролапс тканей выражался в процентном соотношении остаточной площади поперечного сечения просвета сосуда к площади поперечного сечения скафолда.
Недораскрытие стента - уменьшение минимальной площади скафолда (MLA)
вследствие пролабирования через решетки стента, приводящие к потере до 80% MLA от референсного диаметра целевого сосуда.
Диссекция определялась по классификации NHLBI(Rogers & Lasala, 2004).
Результаты На момент написания статьи, нами проведено 20 чрескожных коронарных вмешательств с имплантацией коронарных рассасывающихся каркасов. В общем было установлено 26 скафлодов, из них 14 в группе с ОСТ и 12 в контрольной группе.
В экспериментальной группе в 3-х случаях из 10 выявлены субоптимальные результаты, потребовавшие последующей коррекции: в 1 случае диссекция дистальнее скафолда и пролапс атеросклеротической бляшки через решетки стента, устранены установкой второго скафолда и пост дилатацией; в двух других случаях эксцентричное раскрытие скафолда - модель под острый тромбоз в стенте (Ruiz-Salmeron et al., 2014), устранены пост дилатацией. Кроме того однократно на ОСТ была выявлена диссекция интимы после предилатации, купированная установкой скафолда. Кроме этого в экспериментальной группе однократно наблюдались явления начинающегося тромбоза в стенте, в виде дефекта наполнения, спонтанно разрешившегося на серии ангиограмм после коррекции АСТ дозой клексана 0,4 мл.
.jpg) 1 1 |
.jpg) 2 2 |
.jpg) 3 3 |
| Рисунок 1. Оптическая когерентная томография. На серии изображений оценивается степень прилегания страт стента к стенке сосуда (1), эксцентричность раскрытия скафолда (2), наличие пролапса тканей между страт (3). |
В раннем послеоперационном периоде мы не наблюдали осложнений по конечной точке, все пациенты были выписаны планово и без болевого синдрома. В дальнейшем, через 3 месяца, нами был проведен телефонный опрос пациентов, с использованием стандартизированного бланка опроса. Из опрошенных 20 пациентов, не было выявлено ни одного результата по конечной точке, ни один пациент не отмечал возобновления болевого синдрома.
В настоящее время планируется начать вызов пациентов на госпитализацию, с целью проведения оценки степени резорбции скафолда, наличия признаков рестеноза.
Выводы Несмотря на свою революционность, метод внутрисосудистой реставрации с применением рассасывающихся коронарных каркасов требует тщательной подготовки и интраоперационного контроля. Даже предварительные результаты нашего исследования, говорят о предпочтительности использования методик внутрисосудистой визуализации для оценки степени раскрытия, наличия зон диссекции, тромбоза и эксцентричности скафолда.
Окончательные выводы нашей работы мы планируем предоставить в конце 2015 года.
Список литературы
- Allahwala, U. K., Cockburn, J. A., Shaw, E., Figtree, G. A., Hansen, P. S., & Bhindi, R. (2014). Clinical utility of optical coherence tomography (OCT) in the optimisation of Absorb bioresorbable vascular scaffold deployment during percutaneous coronary intervention. EuroIntervention.
- Brown, A. J., McCormick, L. M., Hoole, S. P., & West, N. E. (2013). Coregistered intravascular ultrasound and optical coherence tomography imaging during implantation of a bioresorbable vascular scaffold. JACC Cardiovasc Interv, 6(7), e41-42. doi: 10.1016/j.jcin.2013.03.018
- Casella, G., Klauss, V., Ottani, F., Siebert, U., Sangiorgio, P., & Bracchetti, D. (2003). Impact of intravascular ultrasound-guided stenting on long-term clinical outcome: a meta-analysis of available studies comparing intravascular ultrasound-guided and angiographically guided stenting. Catheter Cardiovasc Interv, 59(3), 314-321. doi: 10.1002/ccd.10537
- Fitzgerald, P. J., Oshima, A., Hayase, M., Metz, J. A., Bailey, S. R., Baim, D. S., . . . Yock, P. G. (2000). Final results of the Can Routine Ultrasound Influence Stent Expansion (CRUISE) study. Circulation, 102(5), 523-530.
- Fujino, Y., Attizzani, G. F., Bezerra, H. G., Wang, W., Tahara, S., Yamamoto, H., . . . Costa, M. A. (2013). Serial assessment of vessel interactions after drug-eluting stent implantation in unprotected distal left main coronary artery disease using frequency-domain optical coherence tomography. JACC Cardiovasc Interv, 6(10), 1035-1045. doi: 10.1016/j.jcin.2013.05.015
- Fujino, Y., Bezerra, H. G., Attizzani, G. F., Wang, W., Yamamoto, H., Chamié, D., . . . Costa, M. A. (2013). Frequency-domain optical coherence tomography assessment of unprotected left main coronary artery disease-a comparison with intravascular ultrasound. Catheter Cardiovasc Interv, 82(3), E173-183. doi: 10.1002/ccd.24843
- Nakamura, S., Colombo, A., Gaglione, A., Almagor, Y., Goldberg, S. L., Maiello, L., . . . Tobis, J. M. (1994). Intracoronary ultrasound observations during stent implantation. Circulation, 89(5), 2026-2034.
- Oemrawsingh, P. V., Mintz, G. S., Schalij, M. J., Zwinderman, A. H., Jukema, J. W., van der Wall, E. E., & Placement, T. S. T. a. e. a. e. o. U. g. i. L. I. s. (2003). Intravascular ultrasound guidance improves angiographic and clinical outcome of stent implantation for long coronary artery stenoses: final results of a randomized comparison with angiographic guidance (TULIP Study). Circulation, 107(1), 62-67.
- Prati, F., Di Vito, L., Biondi-Zoccai, G., Occhipinti, M., La Manna, A., Tamburino, C., . . . Albertucci, M. (2012). Angiography alone versus angiography plus optical coherence tomography to guide decision-making during percutaneous coronary intervention: the Centro per la Lotta contro l'Infarto-Optimisation of Percutaneous Coronary Intervention (CLI-OPCI) study. EuroIntervention, 8(7), 823-829. doi: 10.4244/EIJV8I7A125
- Rogers, J. H., & Lasala, J. M. (2004). Coronary artery dissection and perforation complicating percutaneous coronary intervention. J Invasive Cardiol, 16(9), 493-499.
- Ruiz-Salmeron, R. J., Pereira, S., & de Araujo, D. (2014). Bioresorbable vascular scaffold collapse causes subacute thrombosis. J Invasive Cardiol, 26(7), E98-99.
- Serruys, P. W., Garcia-Garcia, H. M., & Onuma, Y. (2012). From metallic cages to transient bioresorbable scaffolds: change in paradigm of coronary revascularization in the upcoming decade? Eur Heart J, 33(1), 16-25b. doi: 10.1093/eurheartj/ehr384
- Takarada, S., Imanishi, T., Liu, Y., Ikejima, H., Tsujioka, H., Kuroi, A., . . . Akasaka, T. (2010). Advantage of next-generation frequency-domain optical coherence tomography compared with conventional time-domain system in the assessment of coronary lesion. Catheter Cardiovasc Interv, 75(2), 202-206. doi: 10.1002/ccd.22273
