СОДЕРЖАНИЕ НОМЕРА
КЛИНИКО-ЭКСПЕРИМНЕТАЛЬНОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ АЛЛОТРАНСПЛАНТАТА ДЛЯ ПЕРИТОНИЗАЦИИ РАНЕВЫХ ПОВЕРХНОСТЕЙ ПЕЧЕНИ
А. Р. Шаймухаметов
CLINICAL AND EXPERIMENTAL SUBSTANTIATION TO USE AN ALLOGRAFT FOR PERITONIZATION OF THE LIVER WOUND SURFACES.
A.R.Shaimukhametov
There was developed a new membranous allograft "allogem". During the experiment there was studied and shown hemostasis efficacy with the use of a new membranous alloplastic material "Allogem" in case of liver resection. There was studied the character of the morphological and histological changes of the liver in the contact zone with 'Allogem" hemostatic membrane in the short-term and long-term periods following the liver resection.
КЛИНИКО-МОРФОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ПЕЧЕНИ ПРИ ОБШИРНЫХ РЕЗЕКЦИЯХ
У БОЛЬНЫХ С ДОБРОКАЧЕСТВЕННЫМИ ОБРАЗОВАНИЯМИ
Галимов И. И., Мусина Л.А., Мустафин А. Х.
читать статью
CLINICAL AND MORPHOLOGICAL BASIS OF THE LIVER REGENERATION STIMULATION IN PATIENTS WITH BENIGN FORMATIONS.
Galimov I.I.,
Musina LA., Mustafin A.Kh.
In the process of experimental and clinical investigations there have been studied morphological changes in the liver tissue following the use of the dispersed biological material i.e. the regeneration stimulator after the liver resection. Its use allows to substantially speed up an intensive regeneration of hepatocytes which is manifested in the proliferation and intracellular regeneration of hepatocytes, replenishment of the liver macrophage population and activation. It contributes to the connective tissue involution and restoration of the liver structure. There was developed a complex of measures to stimulate liver regeneration in case of the liver cyst and benign tumour resection, including the insertion of the allogenic regeneration stimulator into the liver tissue after the resection as well as the intraportal laser irradiation, intraportal introduction of hepatotropic drugs and hyperbaric oxygenation to provide restorative compensatory potentialities of the remaining part of the liver and prevention of hepatic insufficiency during the postoperative period.
ВОЗМОЖНОСТИ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ФЕТАЛЬНЫМИ И БИОЛОГИЧЕСКИМИ МАТЕРИАЛАМИ ПРИ ЦИРРОЗЕ ПЕЧЕНИ Янгиров И. В.
читать статью
POTENTIALITIES TO STIMULATE REGENERATION BY FETAL AND BIOLOGICAL MATERIALS IN CASE OF LIVER CIRRHOSIS.
I.V. Yangirov
On the experimental material there was determined a regenerative liver activity in case of cirrhosis against the background of the effect when acted upon different types of surgical regenera-tion stimulation with the aid of biochemical, morphometrical, histological and electron-microscopic methods. A morpho-functional dynamics of the restoration processes was estimated. A morphologi-cal and theoretical substantiation of the combined use efficacy in the clinic of the allogenic dis-persed Alloplant biomaterial and fetal human tissue when treating diffused liver lesions was given in the article.
СТИМУЛЯЦИЯ РЕГЕНЕРАЦИИ И КОРРЕКЦИЯ МИКРОЦИРКУЛЯЦИИ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ ПРИ ЛЕЧЕНИИ ЯЗВЕННОЙ БОЛЕЗНИ
Даутов С. Б.
читать статью
REGENERATION STIMULATION AS WELL AS STOMACH AND DUODENUM CIRCULATION CORRECTION IN THE PEPTIC ULCER TREATMENT. S.B.Dautov
The author implemented new ways of studies of the organic microcirculation in case of the stomach and duodenum peptic ulcer with the use of laser Doppler flowmeter in experimental and clinical investigations. Methods of peptic ulcer surgical treatment with the use of Alloplant allogenic stimulation as well as methods of anastomosis protection with hemostatic and sealing "Allogem" preparation were developed and introduced into clinical practice.
ЭКСПЕРИМЕНТАЛЬНО-МОРФОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ ДИСПЕРГИРОВАННОГО БИОМАТЕРИАЛА В КОМПЛЕКСНОМ ЛЕЧЕНИИ ХИМИЧЕСКИХ ОЖОГОВ ЖЕЛУДКА Мухаметова З. Р.
читать статью
EXPERIMENTAL AND MORPHOLOGICAL JUSTIFICATION FOR THE USE OF DISPERSED BIOMATERIAL IN THE COMPLEX TREATMENT OF THE STOMACH CHEMICAL BURNS Mukhametova Z. R.
It is shown in the work that the endoscopic insertion of dispersed biomaterial “Stimulator of regeneration” (TS 42-2-537-2006) into the stomach submucous layer activates a complex of vascular, cellular and biomechanical reactions. As this takes place, reparative processes in the zone of tissue chemical lesion both during the experiment and in clinical practice are optimized.
ВЛИЯНИЕ ИНДИВИДУАЛЬНОГО ГЛАЗНОГО ПРОТЕЗИРОВАНИЯ НА КАЧЕСТВО ЖИЗНИ БОЛЬНЫХ С АНОФТАЛЬМОМ И СУБАТРОФИЕЙ ГЛАЗНОГО ЯБЛОКА
Рыжов В. А.
читать статью
AN IMPACT OF THE INDIVIDUAL OCULAR PROSTHETICS ON LIFE QUALITY OF ANOPHTHALMUS AND PHTHISIS BULBI PATIENTS
V.A. Ryzhov
The author drew up special questionnaires to determine life quality of anophthalmus and phthisis bulbi patients who fit prostheses. They enable to objectively determine a cosmetic effect of ocular prosthetics and quality of making prosthetic appliances. A design and technology of making plastic cosmetic eye prostheses of different types have improved which allows to reproduce in thick-walled prosthesis a relief iris, anterior chamber depth, smooth limb, intensive-black pupil “opening of diaphragm” whereas in the thin-walled prosthesis of the “crown” type it is possible to reproduce a smooth limb, smooth black pupil, three-dimensional iris with the appliance thickness being small. Based on the developed improved technology of making plastic cosmetic ocular thick-walled prostheses and thin-walled prostheses of the “crown” type there was drawn up a RF patent No. 2164472 “Iris-pupil complex for an ocular prosthesis and method of its making (variants)” is entered in the State Register of inventions of the Russian Federation dated March 27, 2001. There was also registered Eurasian patent No. 003287 dated March 24, 2003 which reads as “Pupil-iris complex for an ocular prosthesis and method of its making (variants)”.
СОЧЕТАННАЯ РЕВАСКУЛЯРИЗИРУЮЩАЯ ОПЕРАЦИЯ В ЛЕЧЕНИИ ДИАБЕТИЧЕСКОЙ РЕТИНОПАТИИ Родионов О.В., Ларин А. И.
читать статью
COMBINED REVASCULARIZING SURGERY IN THE DIABETIC RETINOPATHY TREATMENT Rodionov O.V., Larin A.I.
A combined surgery performance of revascularizing type with the use of Alloplant biomaterials is well-founded on the experimental model of hemophthalmia. It is shown that these surgeries contribute to the accelerated resorption of intraocular hemorrhages with a simultaneous restoration of the ultrastructure of the retinal cellular elements. There are established indications and relative contraindications to perform combined revascularizing surgeries in diabetic retinopathy patients and their clinical efficacy was studied.
ОПТИМИЗАЦИЯ ПАТОФИЗИОЛОГИЧЕСКИХ МЕХАНИЗМОВ РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ РОГОВИЦЫ ЛОКАЛЬНЫМ И АКУПУНКТУРНЫМ ВВЕДЕНИЕМ АЛЛОГЕННОГО ДИСПЕРГИРОВАННОГО БИОМАТЕРИАЛА Мулдашев Э.Р., Галияхметов Р. Ф.
читать статью
PATHOPHYSIOLOGICAL MECHANISM OPTIMIZATION OF THE CORNEAL REPARATIVE REGENERATION BY THE LOCAL AND ACUPUNCTURE INSERTION OF THE ALLOGENEIC POWDERED BIOMATERIAL E.R.Muldashev, R.F.Galiyakhmetov
The authors developed a method of the acupuncture and local (perilimbal) Alloplant biomaterial insertion which is used to stimulate the epithelium reparative regeneration as well as corneal connective tissue structure in case of its experimental burn. The injectible form of Alloplant biomaterial while durably sustaining local vascular and cellular reactions maybe used in pharmacupuncture therapy taking its prolonged effect into account and further full resorption of the graft with no fibrosis in the injection area.
АНАТОМИЧЕСКОЕ ОБОСНОВАНИЕ ХИРУРГИЧЕСКОЙ КОРРЕКЦИИ ПТОЗА ВЕРХНЕГО ВЕКА ПРИ ОФТАЛЬМОПЛЕГИИ Галимова В.У., Салихов Э. А.
читать статью
ANNOTATION ANATOMICAL JUSTIFICATION OF THE UPPER LID PTOSIS SURGICAL REPAIR IN OPHTHALMOPLEGIA V.U. Galimova, E.A. Salikhov
The frontal belly of epicranius into which a tendinous allotransplant and powdered Alloplant biomaterial were being grafted was used for the first time in surgical practice to eliminate the upper lid ptosis in ophthalmoplegia. The results of the clinical application of the developed method to eliminate the upper lid ptosis were studied.
Публикации 2010г.
КЛИНИКО-ЭКСПЕРИМНЕТАЛЬНОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ АЛЛОТРАНСПЛАНТАТА ДЛЯ ПЕРИТОНИЗАЦИИ РАНЕВЫХ ПОВЕРХНОСТЕЙ ПЕЧЕНИ
А. Р. Шаймухаметов
ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Разработан новый пленчатый аллотрансплантат «Аллогем». В эксперименте изучена и показана эффективность гемостаза при резекциях печени с использованием нового пленчатого аллопластического материала «Аллогем». Изучен характер морфологических и гистологических изменений печени в зоне контакта с гемостатической пленкой «Аллогем» в ближайшие и отдаленные периоды после резекции печени.
Актуальность
Печень — сложный орган, с множеством различных функций, жизненно важных для организма. Одна из главных особенностей печени система васкуляризации, представленная воротной веной и печеночной артерией. В норме 80 % крови и 60 % кислорода поступает в печень по системе воротной вены, на долю печеночной артерии приходится соответственно 20 и 40 %. Давление крови в сосудах воротной вены составляет 812 мм.рт.ст., в печеночной артерии 120 мм.рт.ст. (С.А. Шалимов с соавт., 1992).
Обильное кровоснабжение печени, высокая госпитальная летальность при обширных резекциях печени от 6,1% до 32,4% и выше (Б.М. Рахимов и соавт., 1998; Ю.И. Патютко и соавт., 1999), вариабельность и сложность внутриортанной архитектоники, значительное количество послеоперационных осложнений 18,2 71,4% (В.П. Сухорукое и соавт., 1995; А.З. Вафин и соавт.,1999), наряду с отсутствием простых и общедоступных технических приемов, оставляют оперативные вмешательства на печени одними из самых сложных в абдоминальной хирургии (М.А. Галеев, 1996; Б.А. Константинов, С.В.. Готье, 1997; Б.С. Брискин, 1998; О.Г. Скипенко и соавт., 1998).
Проблема надежного гемостаза является одним из основных условий благополучного исхода оперативного вмешательства. Несмотря на широкий спектр стандартных методов остановки кровотечения, иногда бывает трудно добиться хорошего гемостаза при операциях на паренхиматозных органах (А.Н. Северцев и соавт., 1997; В.М. Тимербулатов и соавт., 1998; В.Г. Сахаутдинов и соавт., 1999).
Наиболее часто хирурги применяют наложение швов различных модификаций при резекции печени. Однако обработка культи печени вызывает определенные затруднения: при наложении гемостатических швов на всю глубину культи печени возможно повреждение крупных трубчатых структур, высока вероятность прорезывания паренхимы органа (А.А. Асланян, 1980).
Гемостатические свойства лазера также изучены, но отмечены неудобства лазерной коагуляции культи печени в труднодоступных зонах, а также при продолжающемся кровотечении (М.А. Нартайлаков, 1995).
Гемостатические материалы (порошки, хрупкие губки) не обладают адгезивными и пластическими свойствами, что затрудняет их фиксацию на кровоточащей поверхности (И.А. Сафин, М.А. Нартайлаков, 1992). Для предупреждения прорезывания швов и закрытия культи печени более целесообразно применение аутотканей. Одним из наиболее применяемых материалов в хирургии печени является сальник. Однако изучение отдаленных результатов его применения свидетельствует о развитии рубцового и кистозного перерождения сальника, обширных спаечных сращений и т.д. (Р.Г. Аскерханов, Э.И Гальперин, 1987).
Вышеизложенное обуславливает актуальность проблемы усовершенствования методов обработки культи печени после ее резекции.
Целью настоящего исследования является улучшение результатов резекций печени при ее объемных поражениях путем разработки и внедрения в клинику пластических методов гемостаза и перитонизации резецированной поверхности с использованием аллогенных материалов.
Работа представляет собой клиникоэкспериментальное исследование.
Материалы и методы исследования. Экспериментальные исследования
Экспериментальная часть выполнена на 40 кроликах породы «Шиншилла», которым произведена резекция печени. В зависимости от метода обработки культи печени опыты разделены на 3 серии:
В 1 серии опытов культя печени ушивалась Побразными швами на подкладках из аллотрансплантата.
Во 2 серии опытов перитонизацию культи печени осуществляли прядью сальника на ножке.
В 3 серии опытов культю печени перитонизировали гемостатической пленкой «Аллогем», путем аппликации (табл. 1).
| № серии опытов | Методы обработки культи печени при ее резекции | Кол-во |
| 1 серия | Шов культи печени на подкладках из аллогенного материала | 15 |
| 2 серия | Перитонизация культи печени сальником на ножке | 10 |
| 3 серия | Резекция с перитонизацией культи печени гемостатической пленкой «Аллогем» | 15 |
В сроки от 7 до 360 суток исследовались морфологические изменения в печени путем: оценки состояния гепатоцитов, состояния соединительной ткани, выявления гликогена.
Ультратонкие срезы препаратов просматривались под электронным микроскопом. Всего изучено 600 препаратов.
Установлено, что после резекции печени кроликов с последующим укрытием культи печени пленкой «Аллогем» в паренхиме оставшейся части органа возникают репаративновосстановительные процессы, выражающиеся в активации макрофагов и последующей гипертрофии и гиперплазии гепатоцитов. «Аллогем» плотно срастается с паренхимой печени, частично подвергается резорбции макрофагами и замещается плотной оформленной соединительной тканью в течение 6 месяцев. Образовавшийся соединительнотканный регенерат на месте трансплантации отличается от глиссоновой капсулы несколько большей толщиной за счет иной количественнопространственной организации коллагеновых и эластических волокон. Спаечный процесс отсутствует. В контрольной группе животных с использованием для укрытия раневой поверхности сальника на ножке развивается грубый спаечный процесс с формированием рубцовой ткани и кистозных образований с жировыми включениями на месте применения сальника.
Проведены исследования гемостатических свойств «Аллопланта» по его влиянию на свертывающую систему крови.
Гемостаз изучался по следующим показателям: время рекальцификации плазмы, тромбиновое время, протромбиновое время (табл.2).
Тест |
Плазма (сек.) |
Аллоплант (сек.) |
Аллоплант |
| Время рекальцификации | 82,2±0,6 |
42±0,7 |
49 |
| Тромбиновое время | 15,6+0,1 |
9,1+0,17 |
41,7 |
| Протромбиновое время | 12,5+0,7 |
11,3±1,2 |
9,6 |
В первой серии опытов на смеси донорских плазм без добавления гемостатических препаратов, во второй серии с добавлением препарата «Аллоплант». Получены следующие результаты: время рекальцификации ускорение на 49%, тромбиновое время ускорение на 41,7%, протромбиновое время ускорение на 9,6%.
Данные свидетельствуют о том, что гемостатический потенциал аллопланта связан больше с активацией внутреннего пути свертывания через фактор XII (фактор контакта Хагемана), реализуемый через систему внутреннего тромбопластина, приводящий к превращению протромбина в тромбин, в меньшей степени через внешний путь свертывания (за счет содержащегося в нем тромбопластина).
Данные экспериментальных исследований позволили применить аллогенные материалы в клинической практике.
Клиническая часть работы
Клиническая часть работы включала исследования 286 больных с очаговыми поражениями печени, находившихся на лечении в Республиканском гепатологическом центре в 19952000 годах. Из них резекция печени выполнена 112 больным. Больные прооперированы в основном в плановом порядке. В предоперационном периоде использовались: общеклиническое обследование, лабораторные методы, УЗИ печени, компьютерная томография, реогепатография, скенирование печени, биопсия печени (табл. 3).
| Диагноз | Всего больных | Мужчин | Женщин |
| Гемангиома печени | 105 | 25 | 80 |
| Эхинококкоз печени | 146 | 67 | 79 |
| Поликистоз печени | 8 | 8 | |
| Альвеококкоз печени | 7 | 4 | 3 |
| Злокачественные поражения печени | 20 | 6 | 14 |
| Итого | 286 | 102 | 184 |
Для обработки культи печени нами применялись:
- Аллогенный трансплантат серии «Аллоплант», разработанный во Всероссийском центре пластической хирургии глаза (директор профессор Э.Р. Мулдашев).
- Разработанный нами алломатериал «Аллогем», который является высокоэффективным абсорбирующим гемостатическим препаратом (патент РФ № 2139735 от 20.10.99).
«Аллогем» представляет собой лиофильно высушенную двухслойную пластину размерами 5x10 см, толщиной 1,5 мм. Основой препарата является аллогенная брюшина, с нанесенной на нее смесью, состоящей из рассчитанных количеств фибриногена, тромбина, аминокапроновой кислоты и диспергированного аллотрансплантата серии «Аллоплант».
В сравнительном аспекте изучены результаты резекций печени с использованием аллотрансплантата (50 больных, основная группа) и применением традиционных методов гемостаза (62 больных, контрольная группа). У больных контрольной группы культю печени ушивали Побразным кетгутовым швом, либо сочетали шов печени с закрытием культи печени прядью большого сальника или связками печени (табл. 4).
| Патология | Органосохр. операции или не оперир. | Выполнено резекций | Всего резекций | |
| Контрольная группа | Основная группа | |||
| Гемангиома печени | 67 | 22 | 16 | 38 |
| Эхинококкоз печени | 107 | 20 | 19 | 39 |
| Альвеококкоз печени | 0 | 6 | 1 | 7 |
| Поликистоз печени | 0 | 4 | 4 | 8 |
| Злокачествен. поражение | 0 | 10 | 10 | 20 |
| Итого | 174 | 62 | 50 | 112 |
В основной группе нами применены способы обработки культи печени с применением различных видов аллотрансплантатов. Это ушивание культи печени на подкладочном аллогенном биоматериале, бесшовный способ гемостаза — путем аппликации культи печени пленкой «Аллогем».
При хирургическом лечении 146 пациентов с эхинококкозом печени у 39 больных выполнена эхинококкэктомия с резекцией печени. Из них у 20 (51%) пациентов перитонизация культи печени производилась сальником на ножке. Методика очень удобна, но неприменима при рубцовом сморщивании сальника. В то же время оментопластика предполагает фиксацию сальника к печени, что приводит к спайкообразованию или к нарушениям моторноэвакуаторной функции поперечноободочной кишки. Поэтому с целью устранения негативных моментов оментопластики у 19 (49%) больных использована разработанная нами методика эхинококкэктомии с резекцией печени и применением аллогенных материалов. После удаления пораженной части культю печени перитонизировали аллогенным материалом, путем применения аллопланта как подкладочного материала или применяли гемостатическую пленку «Аллогем» путем ее аппликации на культю печени.
При изучении непосредственных результатов оперативных вмешательств выявлено, что осложнения в обеих группах возникли у 8 (28%) из 39 наблюдений. В первой, контрольной группе осложнения возникли у 7 (33,3%) из 20 пациентов, в виде образования подпеченочных и подциафрагмальных абсцессов. Во второй, основной группе осложнения отмечены у 1 (11%) из 19 пациентов, в виде желчного затека.
В клинике по поводу гемангиом печени обследовались и лечились 105 пациентов. Резекции печени выполнены у 38 (36%) больных. При кавернозных гемангиомах чаще выполнялись анатомические резекции. Это объясняется тем, что гемангиома растет в непосредственной близости с внутрипеченочными сосудами.
Во время резекции печени производилась предварительная обработка сосудистосекреторных элементов удаляемой части органа. Для уменьшения травматичности паренхимы печени использовали ультразвуковой аспиратор «УЗХМ21». Всего с применением аллотрансплантата и гемостатической пленки «Аллогем» прооперировано 16 больных.
Осложнения в контрольной группе (22 больных) отмечены у 3 больных в виде формирования поддиафрагмального абсцесса, потребовавшего проведения релапаротомии. В основной группе осложнений не было.
Умерли 2 больных. Причиной смерти 1 больного, оперированного в экстренном порядке по поводу спонтанного разрыва гемангиомы, несмотря на проведенную правостороннюю гемигепатэктомию, явилось развитие ДВСсиндрома, вследствие чего наступил летальный исход. Смерть второго больного наступила от воздушной эмболии вследствие повреждения стенки нижней полой вены во время операции.
Клинический материал по поводу альвеококкоза печени ограничился семью больными. Резекция печени, выполненная в пределах здоровых тканей, является единственным радикальным методом хирургического лечения этого заболевания. Радикальные резекции печени удалось выполнить всем семи больным. Объем резекции печени определяли в зависимости от локализации, размеров и распространенности процесса, наличия осложнений. Из семи операций по поводу альвеококкоза печени мы применили аллотрансплантат в одном случае. Осложнений после резекции печени не было.
Резекция печени по поводу ее поликистоза была выполнена восьми больным. Ведущее место в хирургии поликистоза печени принадлежит органосохраняющим операциям. Однако в случае полного замещения кистами одной из долей печени необходима резекция данной доли.
У пяти больных проведена резекция правой и у трех резекция левой долей печени в атипичном варианте, что обеспечивает максимальное сохранение функционирующей паренхимы. Аллоплант и гемостатическая пленка «Аллогем» применены в четырех случаях, когда сочетали наложение кетгутовых швов на подкладках из аллопланта и перитонизацию культи печени путем аппликации гемостатической пленки «Аллогем». В данной группе больных осложнений не было. Все больные выписались в удовлетворительном состоянии.
По поводу злокачественных поражений печени нами выполнено 20 резекций. Объем поражения и размер опухоли, устанавливаемые при ультразвуковом исследовании, диагностической лапароскопии, компьютерной томографии, явились для нас основными показателями при определении объема резекции печени.
Оперативные вмешательства с использованием аллотрансплантата и гемостатической пленки «Аллогем» выполнены в десяти случаях. Во всех случаях мы использовали кетгутовые швы на подкладках из аллопланта и в трех случаях сочетали с использованием «Аллогема» методом аппликации.
В послеоперационном периоде в основной группе отмечены осложнения у двух больных в виде образования желчного затека, потребовавшие проведения релапаротомии. В контрольной группе (10 больных) осложнения развились также у двух больных в виде подпеченочных абсцессов. Им произведена релапаротомия, санация, дренирование. Больные выписались в удовлетворительном состоянии.
Таким образом, аллогенные материалы применены всего у 50 больных, перенесших различные по объему резекции печени при ее очаговых поражениях. При этом раневое покрытие «Аллогем» использовано у 24 пациентов для перитонизации культи печени.
Аллотрансплантат в качестве подкладочного материала использовался в 26 случаях. Необходимо отметить, что данный материал применялся у пациентов с измененной паренхимой печени, когда наложение обычных швов вызывало прорезывание ткани печени и сопровождалось кровотечением.
При резекциях печени с применением аллогенных материалов из 50 больных осложнения в раннем послеоперационном периоде возникли у трех пациентов, что составило 6%. Для сравнения в контрольной группе больных (62 пациента), которым произведена резекция печени без применения разработанных нами методик, осложнения отмечены в 12 (19,4%) случаях (табл. 5). Летальность составила 3%.
| Диагноз | Выполненные резекции | Осложнения | ||
| Без алломатериалов | С алломатериалами | Без алломатериалов | С алломатериалами | |
| Гемангиома печени | 22 | 16 | 3 | 0 |
| Эхинококкоз печени | 20 | 19 | 7 | 1 |
| Альвеококкоз печени | 6 | 1 | 0 | 0 |
| Поликистоз печени | 4 | 4 | 0 | 0 |
| Злокачественн. поражения печени | 10 | 10 | 2 | 2 |
| Всего | 62 | 50 | 12 (19,4%) | 3 (6,0%) |
При изучении отдаленных результатов у двух больных, резекция печени которым выполнена по традиционным методикам, спустя 12 и 18 месяцев после операции выявлен симптомокомплекс, характерный для спаечного процесса, что потребовало повторные оперативные вмешательства.
Таким образом, на основании проведенного исследования можно сделать заключение о целесообразности применения аллогенных трансплантатов при выполнении резекций печени.
Комплекс разработанных нами методик по проведению анатомических и атипичных резекций печени с применением аллогенных трансплантатов позволяет осуществлять надежный гемо и холестаз во время операции, уменьшить вероятность развития спаечного процесса в брюшной полости в послеоперационном периоде, снизить частоту послеоперационных осложнений и летальности, уменьшить сроки реабилитации больных.
Заключение
Разработанный пленчатый биоматериал «Аллогем», состоящий из аллогенной пластины и покрытый компонентами фибринового клея, обладает хорошим гемостатическим действием, и эффективен для перитонизации раневых (резецированных) поверхностей печени.
Экспериментальные исследования при применении пленчатого аллотрансплантата «Аллогем» для перитонизации культи печени показали, что гемостатический эффект аллотрансплантата обусловлен самостоятельным кровоостанавливающим действием, за счет активации факторов свертывания крови. В поздние сроки «Аллогем» подвергается резорбции с замещением регенератом, схожим по структуре с глиссоновой капсулой печени.
Применение в клинике при резекции печени пленчатого препарата «Аллогем» обеспечивает надежную перитонизацию культи печени, окончательную остановку паренхиматозного кровотечения и препятствует спайкообразованию в зоне оперативного вмешательства. Наложенный на подкладочном аллогенном материале шов создает равномерно щадящее сдавление печени, не прорезывает его паренхиму, что обеспечивает гемо и холестаз при резекции печени.
Комплекс разработанных методик при выполнении резекций печени позволяет улучшить результаты хирургического лечения объемных образований печени, способствует снижению послеоперационных осложнений.
Практические рекомендации
При операциях на печени для остановки паренхиматозного кровотечения показана перитонизация раневой поверхности биоматериалом «Аллогем», предупреждающим рубцовоспаечный процесс в зоне оперативного вмешательства.
При рыхлой паренхиме печени, когда высока вероятность прорезывания гемостатических швов на культе печени после ее резекции, лигатуры необходимо накладывать на подкладочном аллогенном материале.
При анатомических резекциях печени и возникновении трудностей при выделении долевых и сегментарных сосудов следует применять способ определения сосудистосекреторной ножки.
При больших размерах эхинококковых и непаразитарных кист, поликистозе печени, а также при доброкачественных и злокачественных опухолях и альвеококкозе печени методом выбора является резекция части органа с максимальным сохранением функционирующей паренхимы, применение аллопластических методов гемостаза при этом обеспечивает наилучшие ближайшие и отдаленные результаты.
Литература
- Определение функционального резерва печени по состоянию лизосомального аппарата гепатоцитов // Тезисы докл. 3 конф.хир.гепатологов. СанктПетербург, 1995. С. 5253 (совместно с В.Н. Павловым, М.А. Нартайлаковым, И.А. Сафиным).
- Сравнительная оценка методов хирургического лечения эхинококковых кист печени // «Актуальные проблемы хирургической гепатологии». Томск. 1997 С. 4546 (совместно с М.А. Нартайлаковым, И.А. Сафиным, Р.С. Мингазовым).
- Перитонизация культи печени при ее резекции // Тезисы докл. Республиканской молодежной научной конференции «Вопросы теоретической и практической медицины». — Уфа, 1998. С. 108.
- Совершенствование анатомических резекций печени // Анн. хир. гепатологии, 1998, №3 С. 315 (совместно с М.А. Нартайлаковым, А.Х. Мустафиным).
- Современные аспекты резекций печени // Анналы хирургической гепатологии. 1998, том 3, №3. С. 2325 (совместно с М.А. Нартайлаковым).
- Структурные особенности мембран эритроцитов у больных холециститом, гепатитом // Республиканская научнопрактическая конференция. «Актуальные вопросы гастроэнтерологии». Ишимбай, 1998. С. 31.
- Профилактика гнойносептических осложнений после резекции печени //Анналы хир. гепатологии, 1999, т. 4, №2. С. 120 (совместно с М.А. Нартайлаковым, А.Х. Мустафиным).
- Совершенствование резекции печени при гемангиомах // «Актуальные проблемы хирургической гепатологии». Кемерово, 1999. С. 3334 (совместно с М.А. Нартайлаковым, Х.Х. Мурзабаевым, А.Х. Мустафиным, С.А. Муслимовым).
- Диагностика и лечение гемангиом печени // Здравоохранение Башкортостана, 2000. №12. С. 44 45 (совместно с М.А. Нартайлаковым, А.Х. Мустафиным).
- Разработка и применение «аппаратнопластической» резекции печени // Здравоохранение Башкортостана, 2000. №12. С. 107 109 (совместно с А.Х. Мустафиным, В.Н. Павловым).
- Способ получения материала для укрытия раневой поверхности печени //Патент Российской Федерации № 2139735 от 20.10.99.
- Устройство для наложения гемостатических швов при резекции печени // Положительное решение на выдачу патента № 98117813 / 44 от 20.01.2000.
- Способ лазерной стимуляции регенерации при резекции печени // Удостоверение на рационализаторское предложение № 1892 от 24.03.98 г., выданное Башгосмедуниверситетом.
- Способ моделирования быстрорастущих объемных образований печени в эксперименте // Удостоверение на рационализаторское предложение № 1900 от 24.03.98 г., выданное Башгосмедуниверситетом.
- Способ аппаратнопластической резекции печени // Удостоверение на рационализаторское предложение № 1951 от 10.10.98 г., выданное Башгосмедуниверситетом.
- Устройство для наложения гемостатических швов при резекции печени // Удостоверение на рационализаторское предложение № 1952 от 10.10.98 г., выданное Башгосмедуниверситетом.
- Способ укрытия культи печени при ее резекции // Удостоверение на рационализаторское предложение № 1962 от 12.10.98 г., выданное Башгосмедунивеситетом.
- Способ определения междолевой борозды при анатомической резекции печени // Удостоверение на рационализаторское предложение № 2053 от 31.03.99 г., выданное Башгосмедуниверситетом.
к содержанию | опубликовать статью
КЛИНИКО-МОРФОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ПЕЧЕНИ ПРИ ОБШИРНЫХ РЕЗЕКЦИЯХ У БОЛЬНЫХ С ДОБРОКАЧЕСТВЕННЫМИ ОБРАЗОВАНИЯМИ
Галимов И. И., Мусина Л.А., Мустафин А. Х.
ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию», г. Уфа
В эксперименте и клинике изучены морфологические изменения в печеночной ткани при применении диспергированного биологического материала – стимулятора регенерации после резекции печени. Его применение позволяет значительно ускорить интенсивную регенерацию гепатоцитов, выражающуюся в пролиферации и внутриклеточной регенерации гепатоцитов, восполнении популяции и активации макрофагов печени, что способствует инволюции соединительной ткани и восстановлению структуры печени. Разработан комплекс мероприятий по стимуляции регенерации печени при резекции по поводу доброкачественных опухолей и кист печени, включающий введение аллогенного стимулятора регенерации в ткань печени после резекции, внутрипортальное лазерное облучение, внутрипортальное введение гепатотропных препаратов и гипербарическую оксигенацию для обеспечения восстановительно-компенсаторных возможностей оставшейся части печени и профилактики печеночной недостаточности в послеоперационном периоде.
Актуальность работы
Прошло более 100 лет с тех пор, когда была выполнена первая резекция печени, и несмотря на успехи современной хирургической гепатологии, в диагностике и хирургическом лечении очаговых заболеваний печени остается много сложных и нерешенных вопросов. Вариабельность и сложность внутриорганной архитектоники, значительное количество послеоперационных осложнений 18,2–71,4% (Альперович Б.И., 1997; Вишневский В.А. и соавт., 2008), наряду с отсутствием простых и общедоступных технических приемов и хирургического инструментария, оставляют оперативные вмешательства на печени одними из самых сложных в абдоминальной хирургии. Госпитальная летальность при обширных резекциях печени остается высокой от 6,1 до 32,4% (Сафин И.А. и соавт., 2002; Готье С.В., 2005; Нартайлаков М.А., 2008). Регенерация печеночной паренхимы является одним из важнейших показателей в хирургической гепатологии, определяя во многом исход оперативных вмешательств (Мовчун А.А., 1999; Муслимов С.А., 2000; Гарбузенко Д.В. и соавт., 2001; Вишневский В.А., 2005; Тимербулатов В.М. и соавт., 2008). В клинической практике обсуждение показаний и противопоказаний к обширным резекциям печени неизбежно связано с вопросом достаточности той части неизмененной паренхимы органа, которой в послеоперационном периоде предстоит обеспечивать печеночную функцию (Ганцев Ш.Х., 2004).
Наличие сопутствующего цирроза печени нарушает нормальный процесс компенсации, существенно замедляется динамика восстановления функционального состояния печени, увеличиваются сроки реабилитации больных. Наличие цирроза почти в 10 раз повышает летальность после резекции. В клинике после обширных резекций и резекций у больных с циррозом печени возникает настоятельная необходимость купирования развивающейся печеночной недостаточности и ускорения процессов регенерации в оставшейся части печени (Вишневский В.А., 2007).
Известны методы восстановления и стимуляции регенерации различных тканей и органов с использованием аллогенных биоматериалов серии «Аллоплант», разработанных во Всероссийском центре глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию (директор – профессор Мулдашев Э.Р.). Принципиальным отличием данных биоматериалов является их низкая антигенная активность, которая обусловлена специальной обработкой, предусматривающей дозированную элиминацию гликозаминогликанов из состава коллагеновых волокон, и способность замещения аллопланта собственной тканью реципиента (регенератом) после пересадки (Мулдашев Э.Р., Муслимов С.А., Нигматуллин Р.Т., 2000). Данное свойство аллотрансплантатов явилось принципиальным для возможности их применения в хирургии печени.
В связи с вышеизложенным представляется актуальным поиск путей улучшения результатов хирургического лечения больных с очаговыми заболеваниями печени.
Цель работы: Улучшить результаты резекции печени при её доброкачественных опухолях и кистах путем разработки методов стимуляции регенерации для восстановления морфо-функционального состояния оставшейся части печени.
Задачи работы: В эксперименте изучить морфологические изменения оставшейся части печени после её резекции без применения и с введением аллогенного биоматериала – стимулятора регенерации печени. Разработать и внедрить в клинику методы стимуляции регенераторных процессов в печени после её резекции по поводу доброкачественных и кистозных образований. Оценить функциональное состояние оставшейся части печени в раннем послеоперационном периоде. Изучить ближайшие и отдаленные результаты стимуляции регенераторных процессов в печени после её резекции.
Материалы и методы исследования
В соответствии с целью и задачами исследования проведены эксперименты на 29 кроликах обоего пола породы «Шиншилла» весом от 2,5 до 4,5 кг. Нами изучена возможность применения стимулятора регенерации печени при её резекции. На первом этапе во всех сериях экспериментов всем животным моделировали цирроз печени. Цирротические изменения печени вызывали путем подкожного введения 50% масляного раствора четыреххлористого углерода CCl4 из расчета 0,1–0,2 мл на 1 кг веса животного в течение 3 месяцев (Мингазов Р.С., 1998). После формирования цирроза печени производилась лапаротомия с резекцией ½ доли печени. В зависимости от характера второго этапа, эксперименты разделены на 3 серии (табл. 1). Животных выводили из эксперимента в сроки 7, 14, 30, 90, 120 суток после операции, затем производили забор кусочков ткани печени из зоны операции.
| № серии | Методика операции | Количество n=29 |
| 1-я серия | спонтанная регенерация при экспериментальном циррозе | 9 |
| 2-я серия | резекция ½ доли печени на фоне смоделированного цирроза | 10 |
| 3-я серия | резекция ½ доли печени на фоне цирроза и введения стимулятора регенерации | 10 |
Клиническая часть работы выполнена на результатах обследования и лечения 186 больных, находившихся на лечении в Республиканском центре хирургической гепатологии (руководитель – проф. М.А. Нартайлаков) на базе Республиканской клинической больницы им. Г.Г. Куватова (главный врач – Р.Я. Нагаев) с доброкачественными опухолями и кистами печени (табл. 2) за период с 1995 по 2005 гг. Средний возраст больных составил 42,4±2,5 г.
| Диагноз | Всего больных | Возраст, лет | |||
| до 20 | 20–39 | 40–59 | 60 и старше | ||
| Эхинококкоз | 61 (32,8%) | 5 | 31 | 22 | 3 |
| Альвеококкоз | 19 (10,2%) | 1 | 14 | 3 | 1 |
| Поликистоз | 25 (13,5%) | 2 | 10 | 11 | 2 |
| Гемангиомы | 62 (33,3%) | 17 | 22 | 17 | 6 |
| Посттравматические центральные гематомы печени | 6 (3,2%) | 1 | 5 | – | – |
| Хронические абсцессы печени | 4 (2,2%) | – | 1 | 3 | – |
| Гепатома | 9 (4,8%) | 1 | 5 | 2 | 1 |
| Итого … | 186 (100%) |
Пациенты были разделены на контрольную и основную группы. Основную группу составили 111 (59,7%) больных с доброкачественными опухолями и кистами печени, которым выполнялись хирургические вмешательства с применением разработанных нами методик. Проведенные оперативные вмешательства в объёме обширных резекций печени в основной группе составили 72 (64,9%) больных (рис. 1). Контрольную группу составили 75 (40,3%) больных с доброкачественными образованиями и кистами печени. В структуре проведенных оперативных вмешательств обширные резекции печени в контрольной группе составили 42 (56%) случая (рис. 2). Объём оперативных вмешательств в этой группе был сопоставим с основной группой больных. Клинические группы являлись однородными также по полу и возрасту.
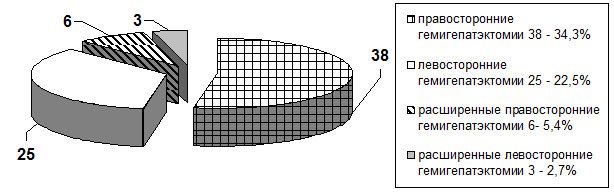
Рис. 1. Распределение обширных резекций печени в основной группе
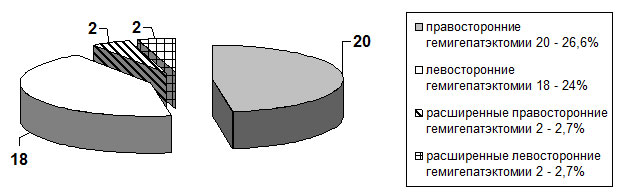
Рис. 2. Распределение объёма обширных резекций в контрольной группе
В диагностике очаговых заболеваний использовались ультразвуковое исследование (УЗИ), КТ, реогепатография, сцинтиграфия, рентгенография, биопсия, лапароскопия. В пред- и послеоперационном периодах функциональное состояние печени оценивали по уровню общего белка и белковых фракций, билирубина, аланин- (АЛТ) и аспартат-аминотрансферазы (АСТ), щелочной фосфатазы, осадочных проб. Функциональная активность печени оценивалась на основании анализа кривых радиогепатограмм.
Результаты экспериментальных исследований
При гистоморфологическом исследовании моделированной циррозом печени кроликов выявлены типичные для этой патологии изменения: на 90 сутки определялись нарушение дольчатости строения печени вследствие разрастания междольковой соединительной ткани с фибропластическими и гистиоцитарно-лимфоидными клетками, а также коллагеновыми и эластическими волокнами, нарушение общей структуры печени, интенсивный фиброз паренхимы с образованием ложных долек. Строма печени проникала в дольку и изолировала отдельные группы гепатоцитов из клеточных пластинок с образованием узлов регенерации (ложные дольки). Количественные исследования гистологических срезов показали, что относительное количество двуядерных гепатоцитов при токсическом отравлении кроликов падает до 5,3%, в то время как у интактных кроликов оно варьирует от 20,7 до 23,1% (р<0,001).
В 1-й серии опытов при спонтанной регенерации печени, деструктивный процесс по всем исследуемым показателям продолжал нарастать вплоть до 7 суток, несмотря на прекращение введения ССl4. В эти же сроки определялись единичные митозы, носящие атипичный характер. Относительное количество двуядерных гепатоцитов уменьшалось в ранние сроки на 7 сутки до 4,6% (р<0,001) и оставалось примерно на одном уровне с небольшими отклонениями до 90 суток. Через 120 суток после отравления относительное количество двуядерных гепатоцитов увеличивалось незначительно, составив 7,7–8,5% (р<0,001 по сравнению с интактной печенью здоровых животных).
Во 2-й серии опытов после резекции 1/2 цирротической печени регенерация её осуществлялась почти исключительно за счет пролиферации гепатоцитов, но, при всем этом, распределение их по классам плоидности и уровню гипертрофии в циррозной печени, даже через длительный период после устранения токсического фактора, резко отличалось от того, которое характерно для нормального органа. В начальные сроки опытов (7 сутки) выявлялась выраженная гипертрофия гепатоцитов и их ядер. На 30-е сутки еще сохранялась жировая и гидропическая дистрофия гепатоцитов, из полиплоидных гепатоцитов чаще встречались двуядерные клетки. На 90 сутки сохраняются гепатоциты с признаками жировой дистрофии, дегенерирующими ядрами и внутриядерными липидными включениями. Количественные исследования показали, что относительное число двуядерных гепатоцитов к 7 суткам опыта резко повышалось (51,9%), на 14 сутки оно уже составляло 63,7% (р<0,01). Через месяц количество двуядерных клеток падало (48,3%), а через 120 суток уже было в пределах нормы (21,7%).
Таким образом, изучение спонтанной регенерации и регенераторного процесса в печени кроликов с экспериментальным циррозом после ее резекции показало, что регенерация печени у больных животных ослаблена.
В 3-й серии опытов в первые дни (на 7 сутки) после введения стимулятора регенерации, последний подвергался резорбции и определялся в виде гомогенных частиц различной величины, интенсивно инфильтрированных базофильными гранулоцитами и мононуклеарами. Уже в ранние сроки (7 сутки) после введения диспергированного биоматериала в цирротически измененную печень кроликов выявлялось большое количество макрофагов. Через 14 суток частицы биоматериала замещались тонкими коллагеновыми волокнами, по ходу которых наблюдались скопления полиморфных одноядерных и двуядерных гепатоцитов. Признаки усиления пролиферативной активности гепатоцитов выражались в виде увеличения относительного количества двуядерных клеток, которые составили 54,5% (р<0,01) через 14 суток и неуклонно продолжали увеличиваться до 30-х суток (73,5%). Ядра макрофагов были с признаками функциональной активности, выражающейся в конденсации хроматина на внутренней части кариолеммы. Подсчет количества фагоцитирующих макрофагов на условное поле зрения показал, что через 14 суток после введения диспергированного биоматериала число их достоверно возрастает до 15,98±0,18, тогда как при циррозе оно составляет 2,98±0,20 (р<0,01). Через 30 суток при электронной микроскопии в синусоидах выявлялся лизис коллагеновых волокон, и в значительном количестве определялись макрофаги, фагоцитирующие коллаген. К 3 месяцам нормализовались межклеточные контакты гепатоцитов и структура желчных канальцев. Через 120 суток среднее количество фагоцитирующих макрофагов приближается к таковому у интактных кроликов.
Таким образом, проведенное нами морфо-функциональное исследование токсически поврежденной печени показало, что резекция печени и введение при этом в оставшуюся культю аллогенного биоматериала стимулирует процессы репаративной регенерации в органе. Созданное депо частиц биоматериала в печени, постоянно стимулируя макрофаги, которые, в свою очередь, стимулируют пролиферацию гепатоцитов, как бы несколько растягивает во времени процесс регенерации.
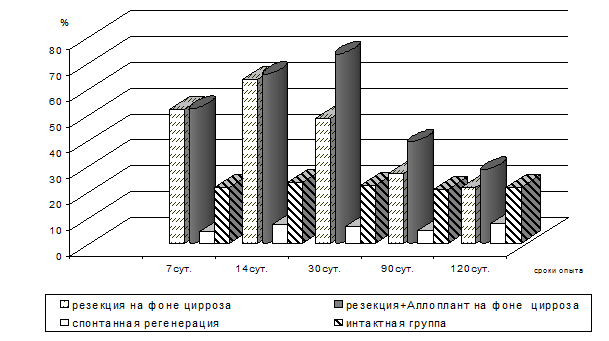
Рис. 3. Относительное количество двуядерных гепатоцитов при резекции
Об этом свидетельствуют полученные результаты количественных исследований числа двуядерных гепатоцитов. У животных 3-й опытной серии относительное количество двуядерных гепатоцитов равномерно возрастало вплоть до 30 суток, в то время как в 2-й серии при резекции печени уже в начальные сроки опыта (7 суток) количество двуядерных гепатоцитов возрастало, а после 14 суток начинало снижаться. В отличие от репаративной регенерации печени при резекции, когда компенсаторно-восстановительные процессы протекают большей частью за счет гипертрофии гепатоцитов, их ядер и печеночных долек, при применении стимулятора регенерации, как показал подсчет количества двуядерных клеток (рис. 3), наблюдается выраженная пролиферация гепатоцитов, и процесс регенерации имеет более физиологические очертания.
Исходя из полученных результатов, темп активации пролиферативных и восстановительных процессов, а также устранение гистиолимфоцитарной инфильтрации паренхимы печени при её резекции выражены в наибольшей степени при использовании стимулятора регенерации, введение которого вызывает интенсивную регенерацию гепатоцитов, выражающуюся в пролиферации и внутриклеточной регенерации гепатоцитов, восполнение популяции и активацию макрофагов печени, что способствует инволюции соединительной ткани и восстановлению структуры печени.
Результаты клинических исследований
Для определения функционального резерва печени путем ультразвукового допплеровского исследования кровотока по воротной вене мы использовали методику, предложенную Э.И. Гальпериным (1994), которая явилась основой матрицы для выбора объёма резекции (табл. 3).
| Исходные данные | Объем резекции печени | Функциональные пробы |
| Балл по шкале АРАСНЕ II Наличие цирроза | Краевая резекция Сегментэктомия Бисегментэктомия Трисегментэктомия Гемигепатэктомия Расширенные резекции | Функциональный резерв по Э.И. Гальперину b-галактозидаза Глюкуронидаза Щелочная фосфатаза |
Параллельно с баллом по АРАСНЕ ІІ аналогично оценивались значения активности маркерных ферментов лизосом – галактозидазы, глюкуронидазы и щелочной фосфатазы. Нами разработана методика резекции печени с использованием стимулятора регенерации, которая применена у 111 (59,6%) пациентов, составивших основную группу. Из них в 47 (42,3%) случаях нами операции выполнялись с соблюдением принципа анатомической резекции с предварительной перевязкой сосудисто-секреторной ножки удаляемой части печени, атипичные резекции применены у 64 (57,7%) больных.
Большая кровопотеря во время операции и трансфузия аллогенной крови чреваты развитием послеоперационных и посттрансфузионных осложнений, являющихся причиной летальных исходов. С целью гемостаза, устранения ишемии в результате кровотечения в плоскости резекции и предупреждения печеночной недостаточности нами был разработан «Способ получения порошкообразного биоматериала для укрытия раневых поверхностей», на который получен патент РФ № 224377 от 10.06.2005 г.
Во всех случаях при резекции печени по поводу объёмных доброкачественных образований, в непораженной опухолью паренхиме печени выявлялись дегенеративные изменения диффузного характера. Создание множественных депо биологического стимулятора в печени мы производили по следующей методике. После проведения лапаротомии и резекции производилось впрыскивание суспензии стимулятора регенерации в дозе до 1,0 мл в каждый сегмент, оставшийся после резекции печени. Предварительно стандартный флакон порошка (1,0 г) стимулятора регенерации разводили на физрастворе в объеме до 20 мл (табл. 4).
| Объём операции | Нозология | ||||
| 1* | 2** | 3*** | 4**** | n | |
| Обширные резекции печени + стимуляция регенерации печени | 35 | 12 | 22 | 3 | 72 |
| Экономные резекции печени + стимуляция регенерации печени | 13 | 6 | 19 | 1 | 39 |
| Итого … | 48 (43,2%) | 18 (16,3%) | 41(36,9%) | 4 (3,6%) | 111 |
Примечание: 1* – объёмные доброкачественные образования печени (гепатомы, гемангиомы); 2** – поликистоз; 3*** – паразитарные поражения печени (эхинококкоз, альвеококкоз); 4**** – хронические абсцессы печени.
С целью предотвращения печеночной недостаточности, улучшения печеночной гемодинамики и процессов лимфообращения печени нами применялся комплекс приемов, который включал: канюлирование воротной вены с внутрипортальным лазерным облучением, внутрипортальную инфузию гепатотропных препаратов, гипербарическую оксигенацию (табл. 5).
| № | Виды оперативных вмешательств | Комплекс мероприятий для стимулирования регенерации печени в послеоперационном периоде с целью профилактики печеночной недостаточности | |||
| стимуляция регенерации | внутрипортальное лазерное облучение | внутрипортальная инфузия гепатотропных препаратов | гипербар. оксигенация | ||
1. |
Обширные резекции печени, в т. ч.: ПГГЭ ЛГГЭ РПГГЭ РЛГГЭ |
72
38 25 6 3 |
48
29 19
|
39
25 14
|
53
29 18 4 2 |
2. |
Экономные резекции печени |
39 |
21 |
26 |
30 |
3. |
Итого n= 111* |
111 (100%) |
69 (62,2%) |
65 (58,6%) |
83 (74,8%) |
Примечание: ПГГЭ – правосторонние гемигепатэктомии; ЛГГЭ – левосторонние гемигепатэктомии; РПГГЭ – расширенные правосторонние гемигепатэктомии; РЛГГЭ – расширенные левосторонние гемигепатэктомии: * – общее количество методик больше количества больных ввиду их сочетания.
Наряду с введением стимулятора регенерации, с целью стимуляции регенерации при резекциях печени нами было применено лазерное облучение воротной крови в 69 (62,2%) случаях, доля которых при обширных резекций составило 48 (69,6%) и при экономных резекциях – 21 (30,4%) случая. Техника проведения заключалась в следующем: через разбужированную пупочную вену интраоперационно катетеризировали воротную вену, либо через один из притоков воротной вены.
В послеоперационном периоде через этот катетер проводили внутрипортальное лазерное облучение крови с использованием гелий-неонового лазера ЛГ-79 с длиной волны 368 мкм, через кварцевый моноволоконный световод с мощностью излучения на выходе 9 мВт. Световод вводили через катетер в воротную вену и облучали портальную кровь по 7–10 минут ежедневно, в течение 5–8 дней. Наряду с лазеротерапией, проводили внутрипортальную инфузию лекарственных препаратов в 65 (58,6%) случаях при резекциях в основной группе: при обширных в 39 (60%) и экономных – в 26 (40%) случаях. Мы вводили гепатотропные (гептрал) препараты, а также препараты, обладающие антикоагулянтным и дезагрегантным действием (трентал), способствующие улучшению реологических свойств воротной крови. В ближайшем послеоперационном периоде в комплексном лечении с целью профилактики печеночной недостаточности, мы также применяли гипербарическую оксигенацию в 83 (74,8%) случаях у больных с невыраженной гипербилирубинемией до 98±2,5 мкмоль/л, которая способствует нормализации газообмена, устранению гипоксии смешанного типа и восстановлению иммунного статуса организма.
Для определения эффективности проводимых методик в послеоперационном периоде больным проводился контроль биохимических показателей крови (общий белок, АЛТ, АСТ, щелочная фосфатаза, билирубин). Уровень трансаминаз (АЛТ, АСТ), щелочной фосфатазы в сыворотке крови у большинства больных в первые сутки после операции повышалось как в основной, так и в контрольной группах. Время восстановления показателей, близких к физиологическим, достоверно (р<0,05) быстрее отмечено в основной группе – средние сроки нормализации основных показателей составили 7,3±1,4 суток, показатели в контрольной группе приближались к нормальным к 13,1±2,7 суткам (табл. 6).
| № | Показатель | Наблюдаемая группа больных | |||||
|---|---|---|---|---|---|---|---|
| основная | контрольная | ||||||
| 1 сут. | 7 сут. | 14 сут. | 1 сут. | 7 сут. | 14 сут. | ||
| 1. | Билирубин мкмоль/л | 48,5±2,1 | 22,6±1,4* | 20,8±1,3 | 47,6±1,8 | 39,4±1,7* | 29,2±1,1 |
| 2. | Белок плазмы, г/л | 57,1±1,8 | 71,5±1,2* | 76,6±3,4* | 56,3±2,4 | 52,1±0,3* | 61,9±1,7* |
| 3. | АЛТ, ед | 68,5±3,5 | 41,3±2,2* | 35.6±1,4* | 66,9±4,1 | 52,7±2,7 | 49,4±4,3* |
| 4. | АСТ, ед | 59,8±4,1 | 44,1±2,9* | 38,2±1,4 | 60,3±2,4* | 52,5±1,3* | 41,5±2,3 |
| 5. | ЩФ, ед | 147,1± 4.45 | 121,4± 2,6* | 110±2,7 | 151,2±18,5 | 144,5± 12,7* | 128,1±7,4 |
| 6. | Средние сроки нормализации показателей | 7,3±1,4 сут. | 13,1±2,7 сут. | ||||
Примечание: * – различия показателей в основной и контрольной группах достоверны (р<0,05).
В послеоперационном периоде осложнения возникли у 17 (22,6%) больных после резекции печени в контрольной группе, и у 8 (7,2%) больных в основной группе (табл. 7).
| Показатели раннего послеоперационного периода | Основная группа | Контрольная группа |
|---|---|---|
| Осложнения: абсцессы желчные затеки кровотечения желчные свищи |
8 (7,2%) 3 2 1 2 |
17 (22,6%) 11 2 2 2 |
| Ранняя послеоперационная летальность | 2 (1,8%) | 3 (3,9%) |
| Средние сроки пребывания в стационаре, сутки | 24,1±2,4 | 28,4±2,5 |
Морфологический материал для изучения ближайших и отдаленных результатов был получен у 17 больных в сроки от 1 месяца до 6 лет. Данной группе больных проводилось контрольное комплексное обследование с пункционной биопсией под УЗИ контролем. По мере прорастания введенного стимулятора регенерации капиллярами на 30 сутки, начинаются процессы его резорбции, сопровождающиеся массивной макрофагальной инфильтрацией (рис. 4).
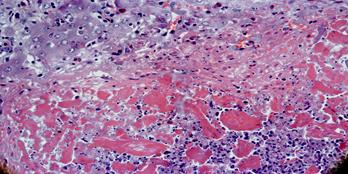
Рис. 4. Массивная макрофагальная инфильтрация частиц стимулятора регенерации на 30 сутки. Окраска гематоксилином и эозином. Увел. х 100
В отдаленные сроки после введения биоматериала (8 мес.) вокруг портальных трактов и центральных вен выявлялись полностью сформированные печеночные балки с интактной структурой гепатоцитов, между которыми определялись четко выраженные синусоиды с выстилкой из эндотелиальных клеток (рис. 5).
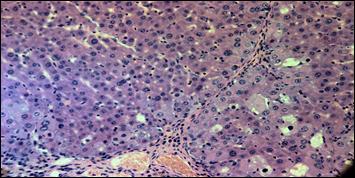
Рис. 5. Биопсийный препарат через 8 месяцев после операции. Окраска гематоксилином и эозином.
Увел. х 100
В более поздние сроки отмечается стабилизация патологического процесса в печени, отмечено улучшение структуры функционально активной паренхимы (рис. 6).
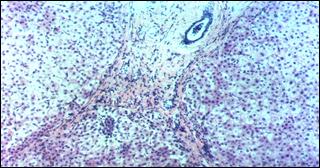
Рис. 6. Микропрепарат печени через 6 лет после резекции печени и введения стимулятора регенерации по поводу альвеококкоза. Окраска гематоксилином и эозином. Увел.×50
При динамическом исследовании структурных изменений в печени с помощью ультразвуковой (УЗИ) и компьютерной томографии (КТ), проводимой в различные сроки после операции, нами отмечено постепенное увеличение объема остатка печени в послеоперационном периоде, при одновременном снижении денситометрических показателей. При этом средние сроки восстановления объёма печени в основной группе происходят достоверно (р<0,05) раньше, чем в контрольной (табл. 8).
| Сроки наблюдения после операции | Группа сравнения | Основная группа | ||
| количество наблюдений | объём восстановленной печени, % | количество наблюдений | объём восстановленной печени, % | |
30 сут. |
38 | 10 | 42 | 15 |
3 мес. |
15 | 20 | 21 | 25–35 |
| 6 мес. | 12 | 25 | 15 | 40–55 |
9 мес. |
12 | 25–35 | 11 | 65–80 |
12 мес. |
9 | 55–70 | 8 | 90–95 |
18 мес. |
9 | 85–90 | 7 | 100 |
24 мес. |
5 | 95–100 | 7 | 100 |
Средние сроки восстановления объёма печени |
16,3±3,5 мес. | 10,5±2,9 мес. | ||
Результаты лечения оценивались по данным общеклинического обследования больных, биохимических и клинических анализов и печеночных проб, ультразвукового исследования, биопсии печени, допплерографии, реогепатографии и компьютерной томографии.
Отдаленные результаты лечения после резекций со стимуляции регенерации исследованы у 55 (49,5%) больных. Группу сравнения составили 32 (42,1%) пациента, у которых наши методики не применялись (табл. 9). При оценке отдаленных результатов хорошим результатом считали отсутствие жалоб и рецидива заболевания, а также полное восстановление трудоспособности. Результат считался удовлетворительным при наличии жалоб преходящего характера, или транзиторных повышениях активности АЛТ и АСТ. Неудовлетворительным считался результат, если были отмечены различные осложнения, потребовавшие повторных вмешательств или прогрессирование заболевания, приводящее к снижению трудоспособности и инвалидности либо к летальному исходу.
Хорошие и удовлетворительные отдаленные результаты достигнуты в основной группе у 94,5% больных, тогда как в контрольной – в 81,3%.
| Результаты | Контрольная группа (n=32) | Основная группа (n=55) | Всего больных (n=87) |
| Хороший Удовлетворительный Неудовлетворительный | 10 (31,3%) 16 (50 %) 6 (18,7%) | 34 (61,8%) 18 (32,7%) 3 (5,5%) | 44 (50,6%) 34 (39,1%) 9 (10,3%) |
| Итого … | 32 (100%) | 55 (100%) | 87 (100%) |
Таким образом, при лечении доброкачественных очаговых заболеваний печени методом выбора радикального лечения является резекция печени. Разработанный и внедренный комплекс мероприятий, включающий применение аллогенного биоматериала, внутрипортальную инфузию гепатотропных лекарственных препаратов, внутрипортальную лазеротерапию и гипербарическую оксигенацию с целью стимуляции регенерации оставшейся после резекции части печени на фоне её дегенеративных изменений паренхимы, способствует быстрейшему восстановлению функционального состояния печени, предупреждает развитие гепатоцеллюлярной недостаточности в послеоперационном периоде, что позволяет снизить интра- и послеоперационную летальность и уменьшить сроки реабилитации больных после резекции печени.
Выводы и практические рекомендации
Спонтанная регенерация печени при экспериментальном циррозе, когда регенераторный потенциал в органе снижается, и репаративная регенерация цирротически измененной печени после резекции, осуществляющейся за счет гипертрофии гепатоцитов и органа, не приводит к полной резорбции соединительной ткани и восстановлению печени животных. Резекция печени кроликов и введение в оставшуюся культю стимулятора регенерации печени усиливает регенераторный потенциал в виде восстановления физиологической регенерации гепатоцитов, приводящей к резорбции цирротической соединительной ткани и восстановлению печени животных.
Применение в клинике разработанного комплекса лечебных мероприятий на оставшуюся паренхиму печени при обширных резекциях по поводу очаговых поражений, включающий введение диспергированного биологического материала «стимулятор регенерации печени», внутрипортального лазерного облучения и инфузию гепатотропных препаратов, гипербарическую оксигенацию, улучшает процессы репаративной регенерации с восстановлением морфо-функциональной активности паренхимы печени и является методом выбора для профилактики послеоперационных осложнений и снижения летальности пациентов.
Обширные резекции печени у больных с различными доброкачественными очаговыми образованиями печени сопровождаются развитием печеночной недостаточности с резким угнетением функционального состояния печени: повышением активности аминотрансфераз – АЛТ свыше 68,5±3,5 ед., АСТ свыше 59,8±4,1 ед., гипербилирубинемией свыше 48,5±2,5 мкмоль/л., гипопротеинемией менее 57,1±1,8 г/л., с постепенной нормализацией этих показателей к 7,3±1,4 суткам при использовании разработанного комплекса мер по стимуляции регенерации печени, и лишь к 13,1±2,7 суткам – при традиционном ведении послеоперационного периода.
Внедрение комплекса мер по стимуляции регенерации печени после её резекции позволило снизить частоту клинически значимых проявлений печеночной недостаточности, летальность – с 3,9 до 1,8%. В отдаленные сроки полное восстановление объёма печени происходит к 10,5±2,9 мес. в основной группе больных, и лишь к 16,3±3,5 мес. – в контрольной группе (р<0,05). Хорошие и удовлетворительные отдаленные результаты достигнуты в основной группе – в 94,5% случаев, тогда как в контрольной – лишь у 81,3% больных.
При лечении очаговых доброкачественных образований печени методом выбора радикального лечения является резекция до обширных резекций печени. При обширных резекциях и при резекциях у больных с циррозом печени для стимуляции регенераторных процессов и обеспечения компенсаторно-восстановительных процессов в оставшейся части печени целесообразно применение комплекса мероприятий, включающего введение биостимулятора регенерации во все сегменты печени с помощью безигольного инъектора, внутрипортальное лазерное облучение.
Аллогенный биостимулятор регенерации вводят после основного этапа резекции печени посегментарно безигольным инъектором в дозе 10 г сухого порошка, разведенного в 20–30 мл. 0,25% новокаина.
После этапа резекции печени необходимо катетеризировать воротную вену путем разбужирования пупочной или канюлирования одного из притоков воротной вены. В послеоперационном периоде целесообразно проводить внутрипортальное лазерное облучение крови с использованием гелий-неонового лазера ЛГ-79 с длиной волны 368 мкм, через кварцевый моноволоконный световод с мощностью излучения на выходе 9 мВт., по 7–10 минут ежедневно в течение 5–8 дней, для улучшения микроциркуляции и усиления регенераторных процессов в печени.
Внутрипортальное введение лекарственных гепатотропных препаратов (гептрал, трентал) и гипербарическую оксигенацию после резекции печени необходимо проводить в ближайшем послеоперационном периоде в условиях реанимационного отделения.
Литература
- Галимов, И.И. Возможности склерозирующей терапии при лечении гемангиом печени / И.И. Галимов, А.И. Грицаенко, Д.С. Губин // Материалы 68-й Республиканской итоговой научно-практической конференции студентов и молодых ученых РБ. – Уфа, 2003. – С. 73–76.
- Наш опыт хирургического лечения гемангиом печени / И.И. Галимов, А.Х. Мустафин, Н.Н. Калимуллин [и др.] // Здравоохр. Башкортостана. – 2004. – № 3. – С. 25–26.
- Галимов, И.И. Хирургическое лечение гемангиом печени / И.И. Галимов, А.И. Грицаенко, Д.С. Губин // Материалы IV Республиканской итоговой научно-практической конференции студентов и молодых ученых РБ. – Уфа, 2003. – С. 95–97.
- Гемангиома печени: диагностика и лечение / И.И. Галимов, М.А. Нартайлаков, А.Х. Мустафин, А.И. Грицаенко // Здравоохр. Башкортостана. – 2004. – № 3.– С. 212–213.
- Разработка материалов для перитонизации печени при резекции / И.И. Галимов, А.Х. Мустафин, Н. В. Пешков, А.И. Грицаенко // Анналы хирургической гепатологии, т. 10 / Сборник тезисов XII международного Конгресса хирургов–гепатологов стран СНГ. – Ташкент, 2005. – С. 117–118.
- Галимов, И.И. Оценка эффективности стимуляции регенерации при обширных резекциях печени / И.И. Галимов, М.А. Нартайлаков, А.И. Грицаенко // Анналы хирургической гепатологии, т. 10 / Сборник тезисов XII международного Конгресса хирургов–гепатологов стран СНГ. – Ташкент, 2005. – С. 132–133.
- Наш опыт хирургического лечения гемангиом печени / И.И. Галимов, А.Х. Мустафин, Н.Н. Калимуллин, А.И. Грицаенко // Анналы хирургической гепатологии, т. 10 / Сборник тезисов XII международного Конгресса хирургов-гепатологов стран СНГ. – Ташкент, 2005. – С. 107–108.
- Галимов, И.И. Способ применения пластических материалов для перитонизации печени при резекции / И.И. Галимов, А.Х. Мустафин, А.И. Грицаенко // Анналы хирургической гепатологии. – 2007. – Т. 12, № 3 – С. 90.
- Новые возможности лечения метастатических поражений печени / М.А. Нартайлаков, А.Х. Мустафин, И.И. Галимов [и др.] // Анналы хирургической гепатологии. – 2007. – Т. 12, № 3 – С. 138–139.
- Применение аллогенных биоматериалов в хирургии диффузных и кистозных заболеваний печени / М.А. Нартайлаков, И.И. Галимов, Р.С. Мингазов [и др.] // Медицинский вестник Башкортостана. – 2007. – Т. 2, № 3–4. – С. 25–35.
- Морфологические изменения печени после ее резекции и введения биоматериала Аллоплант / А.Х. Мустафин, М.А. Нартайлаков, И.И. Галимов [и др.] // Морфологические ведомости. – 2008. – № 3–4. – С. 23–25.
к содержанию | опубликовать статью
ВОЗМОЖНОСТИ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ФЕТАЛЬНЫМИ
И БИОЛОГИЧЕСКИМИ МАТЕРИАЛАМИ ПРИ ЦИРРОЗЕ ПЕЧЕНИ
Янгиров И. В.
ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию», г. Уфа
С применением биохимических, морфометрических, гистологических и электронномикроскопических методов на экспериментальном материале определена регенеративная активность печени при циррозе на фоне воз-действия различных видов хирургической стимуляции регенерации, оценена морфо-функциональная динамика восстановительных процессов. В статье дано морфологическое и теоретическое обоснование эффективности сочетанного применения в клинике аллогенного диспергированного биоматериала и фетальной ткани человека при лечении диффузных поражений печени.
Актуальность
Одной из самых тяжелых патологий гепатопанкреатодуоденальной зоны являются диффузные заболевания печени: хронические гепатиты и циррозы печени (Сафин И.А., 1986).
Заболеваемость населения нашей страны острыми гепатитами только за последние три года увеличилась в 2-2,5 раза. Фактические же цифры значительно выше, т.к. официально регистрируются только желтушные формы, составляющие 25 % от числа всех случаев. Хронизация процесса происходит у 30-40 % больных и примерно у половины из них в последующие 10 лет развивается цирроз печени (Голосова Т.В. и соавт., 1993; Ивашкин В.Т., 2002). В экономически развитых странах цирроз печени входит в число шести основных причин смерти у лиц в возрасте 36-64 года (Подымова С.Д., 1998). Несмотря на определенные успехи в понимании патогенеза и терапии этих заболеваний, прогноз при хронических гепатитах и циррозах печени остается неудовлетворительным, а смертность имеет стойкую тенденцию к росту. Положительный эффект при лечении хронических гепатитов и ранних стадий циррозов печени отмечен лишь у 30-50 % всех больных этим заболеванием (Апросина З.Г., 1996). У больных в стадии компенсации пятилетняя выживаемость составляет 62 %, а десятилетняя – 51 %; в стадии декомпенсации эти показатели составляют соответственно 19 и 9,9 % (Мочалова Ю.С. и соавт., 1985).
В настоящее время радикальным хирургическим методом лечения хронических гепатитов и циррозов печени является ортотопическая трансплантация печени (Вишневский В.А., Кубышкин В.А., Чжао С.В. и соавт., 2003; Готье С.В. и соавт., 2005), однако ее техническая сложность, дефицит донорских органов, высокая себестоимость лечения толкают на форсированное развитие экономически доступных методов лечения. Главной альтернативой пересадке органа рассматривают стимуляцию регенерации печени.
Существующие методы, направленные на усиление репаративной регенерации печени, в большинстве случаев дают определенный положительный эффект, но кардинально не решают проблему регенерации печени (Цирятьева С.Б., 2002; Нартайлаков М.А. и соавт., 2004).
Одним из способов коррекции патологического процесса при хронических гепатитах и циррозах печени посредством воздействия на регенерацию печеночных клеток является применение диспергированного биоматериала. В эксперименте и клинике показано, что при его внутрипеченочном введении активизируется процесс резорбции собственного избыточного коллагена печени (Мингазов Р.С., 1999; Мусина Л.А., 1999; Павлов В.Н. и соавт., 2000; Муслимов С.А., 2000).
В последние годы перспективным считается пересадка фетальных тканей человека (Батанов А.Н., 2001). Выделяют специфический и неспецифический механизм действия фетальных тканей. Специфический механизм действия – это заместительная клеточная терапия. Неспецифический механизм действия – стимуляция регенераторных процессов за счет стадиоспецифических белков, пептидов (ростовые факторы, цитокины, тканевые гормоны). Кроме того, фетальные ткани не вызывают реакции отторжения, поскольку в 1 и 2 триместрах гестации еще не экспрессированы белки гистосовместимости 1 и 2 класса, способны использовать эволюционно более древний энергетический путь – гликолиз, поэтому обладают большей устойчивостью к гипоксии (Пышкин С.А. и соавт., 2000).
В связи с разными механизмами стимулирующего воздействия на регенерацию печени аллогенного диспергированного биоматериала и фетальных тканей человека, возникла гипотеза о потенцировании их эффекта при совместном применении.
Исходя из изложенного, целью работы явилось исследование регенераторных процессов в печени при экспериментальном циррозе при воздействии фетальных и биологических материалов.
Материалы и методы исследования
В соответствии с целью и задачами исследования проведены эксперименты на 150 белых крысах линии Вистар (самцы, m=250-300гp.). Животных содержали в стационарных условиях вивария при температуре 18-20˚С, на смешанном рационе питания со свободным доступом к воде. Перед проведением эксперимента крыс выдерживали в карантине 20 дней. Все болезненные манипуляции проводили под эфирным наркозом, животных выводили из опыта методом цервикальной дислокации.
В процессе эксперимента оценку состояния крыс проводили на основании макроскопических признаков (выпадение волос, гиподинамия, желтушность кожных покровов, изменение массы тела, визуальный осмотр печени при оперативных вмешательствах), изменений биохимических показателей сыворотки крови и данных световой и электронной микроскопии.
В начале эксперимента для определения нормальных (исходных) величин изучаемых показателей исследовали 6 здоровых крыс, составивших 1-ю опытную группу.
Модель цирроза была получена путем длительного введения внутрижелудочно гепатотропного яда – тетрахлорметана в течение 3 месяцев (2-я опытная группа животных) по схеме (Шалимов С. А., Радзиховский А. П., 1989; Мингазов Р.С., 1998). Летальность составила 19,4 %. Отмечено снижение массы тела у каждой особи в среднем на 45±9,7 гр.
Для изучения активности репаративных процессов крыс с циррозом печени разделили на группы: 3-я опытная группа – без каких-либо терапевтических воздействий; 4-я опытная группа – лапаротомия с резекцией части печени; 5-я опытная группа – лапаротомия со стимуляцией регенерации печени аллогенным биоматериалом; 6-я группа – с трансплантацией фетальной ткани; 7-я группа – лапаротомия с сочетанным применением аллогенного биоматериала и трансплантацией фетальной ткани (рис. 1).
Стимуляцию регенерации аллогенным биоматериалом проводили по следующей методике: из лапаротомного доступа в каждую долю печени вводили по 0,1-0,2 мл суспензии биоматериала крыс, который заготавливался в тканевом банке Всероссийского центра глазной и пластической хирургии (дир. – проф. Э.Р. Мулдашев) по технологии Аллоплант® в соответствии с требованиями ТУ 42-2-537-2002.
Для стимуляции репаративных процессов трансплантацией фетальной тканью использовали печень 19-ти дневных эмбрионов крыс. Материал готовили сотрудники Челябинского Биомедицинского центра на основании лицензии ЛАКО Челябинской области № 435. Трансплантацию проводили предбрюшинно инъекцией 1 мл. суспензии (3-5×105 ядросодержащих клеток).
Для оценки процессов холестаза и цитолиза в паренхиме печени определяли уровень билирубина и активность аминотрансфераз (АлАТ и АсАТ) сыворотки крови. Уровень билирубина сыворотки крови определяли по унифицированному методу Ендрашика. Измерение оптической плотности осуществлялось на фотоэлектрокалориметре КФК-2МП.
Активность аминотрансфераз сыворотки крови определяли по унифицированному методу Райтмана-Френкеля. Оптическая плотность измерялась на фотоэлектрокалориметре КФК-3. 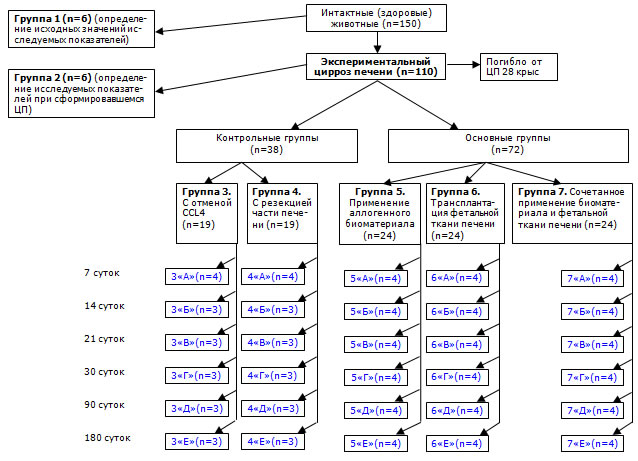 Рис. 1. Распределение экспериментального материала.
Рис. 1. Распределение экспериментального материала.
Примечание: животные разделены на серии «А», «Б», «В», «Г», «Д», «Е» в соответствии со сроками вывода из эксперимента.
Животные выводились из опыта на 7, 14, 21, 30, 90, 180 сутки после операции. Забор материала осуществляли следующим образом: после вскрытия брюшной полости методом макромикроскопического препарирования выделяли печень, производили взвешивание органа, определяли развитие соединительнотканной стромы и паренхимы. При этом производили прицельный забор ткани для гистологического исследования под микроскопом МБС-2. Объем органа определяли путем его погружения в градуированную емкость с водой. Для гистологического исследования кусочки печени фиксировали в 10%-ном нейтральном формалине, обезвоживали их в серии спиртов возрастающей концентрации и заливали в парафин. Парафиновые срезы окрашивали гематоксилином и эозином, для выявления соединительной ткани окрашивали по Ван-Гизону и по Маллори. Результаты оценивали по бальной оценке гистологических признаков (0-4 баллов) (Пирогова И.Ю., 2003):
- Воспалительно-клеточная инфильтрация паренхимы и стромы.
- Ступенчатый некроз печеночных клеток.
- Фиброз.
- Гипертрофия ядер гепатоцитов.
- Гиперплазия ядер гепатоцитов.
- Пролиферация желчных протоков.
- Дистрофия гепатоцитов.
Бальную оценку морфологических изменений проводили в 10 полях зрения препарата печени от каждого животного, с учетом степени выраженности изучаемого признака на всей площади среза, причем из каждого кусочка печени изготовляли не менее 5 срезов одной окраски. Подсчет двуядерных гепатоцитов проводили на срезах, окрашенных гематоксилином и эозином. Процентное соотношение двуядерных гепатоцитов считали на 2000 просчитанных клеток.
Для электронно-микроскопического изучения кусочки печени фиксировали в растворе 2%-го глютарового альдегида на какодилатном буфере (рH 7,2-7,4), постфиксировали в 1%-ом растворе четырехокиси осмия на том же буфере. Обезвоживание и заливку в эпон-812 проводили по общепринятой методике (Б. Уикли, 1975). Предварительно изготавливали полутонкие срезы толщиной 1 мкм и окрашивали их толуидиновым синим на 2,5%-ом растворе безводной соды. На полутонких срезах выбирали участки для электронно-микроскопического исследования. Ультратонкие срезы получали на ультрамикротоме LKB-III 8800 (Швеция), контрастировали 2%-ым водным раствором уранилацетата и цитратом свинца по Рейнольдсу (Б. Уикли, 1975) и изучали в электронном микроскопе "JEM-7А" (Япония) при увеличениях от 2000 до 30 000.
Всего изучено 340 парафиновых блоков, 1500 гистологических препаратов, 50 полутонких срезов, 35 блока для ультратонких срезов.
Статистический анализ проводился с помощью комплекта компьютерных программ «Stadia-6». Для оценки статистической значимости различий между сопоставляемыми средними величинами использовали критерий Стьюдента «t». Для выявления отличных от средних тенденций различий между выборками применяли критерий Смирнова-Колмогорова (l); его использовали также в тех случаях, когда доля наблюдений в одной из выборок равнялась нулю. Применялись также критерий Уайта и критерий Пирсона (c2). Результаты считали достоверными при p<0,05.
Основные результаты собственных исследований
Результаты морфологических исследований
В первой группе мы исследовали интактных крыс. Структура печени соответствовала норме. Печень крыс покрыта тонкой соединительнотканной Глиссоновой капсулой, отдающей вглубь органа очень тонкие прослойки, которые разделяют его на дольки. Эти прослойки выражены очень слабо и не выявляются. Границы печеночных долек определяются только по расположению междольковых сосудов и желчных протоков, которые составляют ″триады″, характерные для печени млекопитающих.
Во второй группе (6 крыс) цирроз печени был подтвержден к концу 3-го месяца интоксикации визуальным осмотром брюшной полости и гистологическим исследованием печени. Отмечалась желтушность кожных покровов, гиподинамия, выпадение волос, потеря веса. Выраженная патология отмечена у крыс при лапаротомии – плотная поверхность печени красноватой окраски, зернистость, закругленность краев. Изменения относительной массы печени (весовой коэффициент), объема печени в процессе эксперимента представлены на рисунке 2. 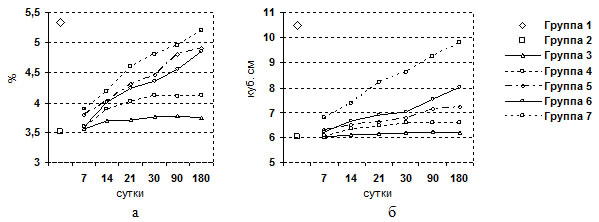
Рис. 2. Динамика изменения относительной массы печени крыс (а) и объема (б) печени крыс в различные сроки эксперимента.
Морфологически наблюдалась белковая и жировая дистрофия печеночных клеток, потеря балочной структуры паренхимы печени, интенсивное разрастание соединительной ткани вокруг портальных трактов, узловая трансформация паренхимы печени с формированием ложных долек, разделенных между собой фиброзными тяжами. В соединительнотканных прослойках отмечалось образование шунтирующих сосудов. Наряду с дистрофией, некрозом, фибропластическими процессами и перестройкой печеночных долек, почти во всех случаях в разной степени наблюдались признаки слабовыраженной регенераторной активности. Она выражалась в гипертрофии гепатоцитов и наличии небольшого количества двуядерных клеток при диффузном прорастании паренхимы соединительной тканью, и единичных регенераторных гепатом - при образовании ложных долек. Гепатомы состояли из гипертрофированных одно- и двуядерных гепатоцитов со светлой цитоплазмой и гиперхромными ядрами. В паренхиме печени выявлялась также компенсаторно-приспособительная пролиферация междольковых желчных протоков. Часто вокруг этих протоков определялись воспалительные инфильтраты, состоящие из лимфоцитов и плазматических клеток. Изменения у подопытных животных таких показателей как воспалительно-клеточная инфильтрация клеток и паренхимы, ступенчатый некроз печеночных клеток, гипертрофия и гиперплазия гепатоцитов, пролиферация желчных протоков, дистрофия гепатоцитов, фиброз представлены в графическом изображении (рис. 3-9).
При электронно-микроскопических исследованиях цирротически измененной печени крыс в гепатоцитах были выявлены признаки жировой дистрофии в виде крупных липидных капель в цитоплазме или белковой дистрофии с частичной или полной деструкцией органелл.
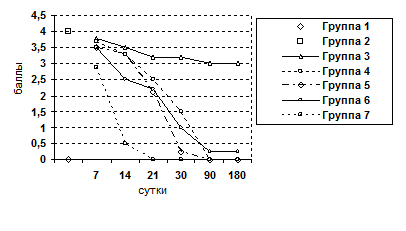
Рис. 3. Изменение воспалительно-клеточной инфильтрации клеток и паренхимы
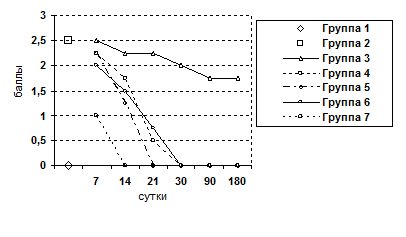
Рис. 4. Изменение показателя некроза печеночных клеток.
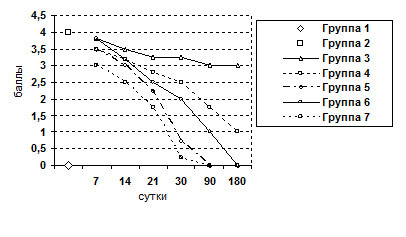
Рис. 5. Изменение показателя фиброза ткани печени.
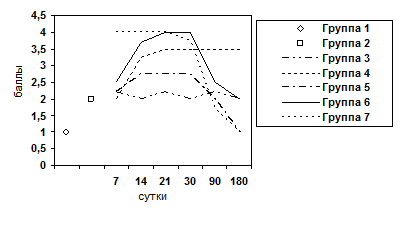
Рис. 6. Изменение показателя гипертрофии ядер гепатоцитов.
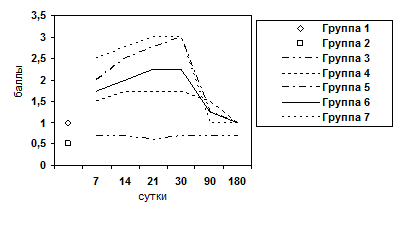
Рис. 7. Изменение показателя гиперплазии ядер гепатоцитов.
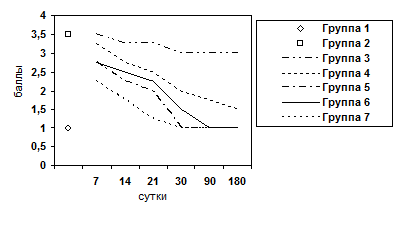
Рис. 8. Изменение показателя пролиферации желчных протоков.
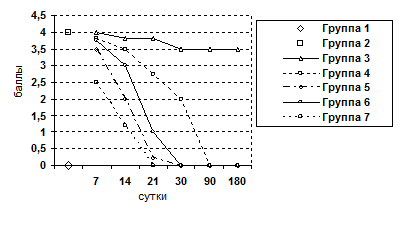
Рис. 9. Изменение показателя дистрофии гепатоцитов.
Встречались клетки с признаками зернистой дистрофии со снижением электронной плотности цитоплазмы, содержащей хлопьевидные глыбки денатурированного белка и клетки с гидропической (вакуольной) или баллонной дистрофией. При гидропической дистрофии выявлялось набухание митохондрий с деструкцией крист, резкое расширение каналов гранулярного эндоплазматического ретикулума с потерей рибосом и образование вакуолей, заполненных хлопьевидным содержимым. Гликоген в клетках не определялся. Выявлялись также клетки с признаками некроза, проявляющиеся в деструкции органелл, кариопикнозе. В межклеточных пространствах выявлялись фибробласты и пучки коллагеновых волокон.
У крыс контрольной третьей группы, выведенных из эксперимента в разные сроки после прекращения действия тетрахлорметана, гистологическая и электронно-микроскопическая картина соответствовала вышеописанной картине цирротически измененной печени. У них выявлялся монолобулярный цирроз с образованием ложных долек и прорастанием шунтирующих сосудов в соединительнотканных прослойках между ложными дольками. У большинства животных, выведенных из опыта через 30, 90 и 180 суток, макроскопически на печени были обнаружены регенераторные узелки различной величины, округлой формы, интенсивно-красного цвета. Гистологические исследования кусочков печени выявили в паренхиме прослойки зрелой соединительной ткани, интенсивно окрашивающейся по Маллори и по Ван-Гизону, малоинфильтрированной клеточными элементами, характеризующиеся как пассивные септы постнекротического цирроза печени. Размеры клеток варьировали. Гепатоциты располагались беспорядочно без типичной трабекулярности. Встречались двуядерные и даже трехъядерные гепатоциты.
При гистологическом исследовании экспериментального материала в четвертой группе после резекции печени выявлены следующие морфологические изменения. В течение первых дней после операции (7 суток) выявлялись реактивные изменения паренхимы печени, типичные для травмы: сильно выраженный отек, очаговые кровоизлияния и изменения цвета печени, резкое расширение синусоидов, отдельных портальных сосудов и центральных вен, выраженный стаз в них элементов крови. Гистологически уже в первые дни по всей толще оставшейся части органа отмечались признаки репаративных процессов. Они выражались в увеличении количества Купферовских клеток, гипертрофии большинства гепатоцитов и их ядер, появлении в ядрах нескольких ядрышек, пролиферации гепатоцитов и увеличении количества двуядерных клеток, расширении желчных протоков и перестройке сосудистой системы.
К 14 суткам явления отека исчезали. Наблюдались процессы пролиферации желчных протоков. Выявлялось большое количество гипертрофированных гепатоцитов с большими ядрами. Увеличивалось количество двуядерных гепатоцитов. В последующие сроки (21-30 дней) в паренхиме печени продолжало увеличиваться количество двуядерных гепатоцитов. Восстанавливалось состояние цитоплазмы печеночных клеток, при окраске гематоксилином и эозином они окрашивались в розовый цвет. В дальние сроки экспериментов (90 и 180 суток) структура печени частично восстанавливалась. Большинство тяжей соединительной ткани подвергалось процессу инволюции, они исчезали, но не полностью.
Таким образом, после частичной резекции печени крыс в паренхиме возникали репаративно–восстановительные процессы, выражающиеся в активации макрофагов и последующей гипертрофии и гиперплазии гепатоцитов. Значительным и основным фактором в восстановлении паренхимы являлась полиплоидия печеночных клеток, выражающаяся в увеличении размеров ядер гепатоцитов и гипертрофия самих клеток. Соединительнотканные тяжи между печеночными дольками исчезали не полностью.
В пятой группе опытов через 7 суток после введения в цирротически измененную печень крыс диспергированного биоматериала, он определялся в виде гомогенных частиц различной величины, инфильтрированных небольшим количеством мононуклеарных клеток. Биоматериал подвергался интенсивной деколлагенизации и лизису - по Маллори частицы окрашивались в фиолетово-красные тона, а по Ван-Гизону – в оранжево-желтые. Частицы биоматериала активно резорбировали макрофаги. По периферии зоны введения биоматериала выявлялись очень тонкие новообразованные волокна. В окружающей паренхиме воспалительная реакция была слабо выраженной: незначительный отек и инфильтрация единичными лейкоцитами, сосудистый стаз. Обращало на себя внимание появление в окружающих сосудах и расширенных синусоидах значительного количества моноцитов со светлой цитоплазмой и темным овальным или бобовидным ядром. Выраженной особенностью являлось их диффузное распределение в паренхиме. В синусоидах определялось большое количество активно резорбирующих макрофагов.
Наряду с признаками дистрофии гепатоцитов и фибропластических процессов в паренхиме печени наблюдали выраженные признаки регенераторной активности в виде гипертрофии гепатоцитов и заметного увеличения количества двуядерных клеток. Гипертрофированные гепатоциты имели крупные ядра, в которых четко просматривались одно или два ядрышка, богатые гранулярным веществом. На ультраструктурном уровне в двуядерных гепатоцитах выявлялось большое количество митохондрий и гиперплазия каналов гранулярного эндоплазматического ретикулума.
Спустя 14 суток в паренхиме печени частиц биоматериала уже не обнаруживалось, вместо них выявлялись небольшие участки рыхлой новообразованной соединительной ткани, окрашивающейся по Ван-Гизону в нежно-розовый цвет, между которыми небольшими островками располагались группы мелких гепатоцитов с равномерно окрашивающейся цитоплазмой и небольшими, одинаковых размеров, ядрами. Здесь же выявляли скопления фибробластов и мононуклеарных клеток со светлой цитоплазмой, большими, овальной формы ядрами. В этих группах клеток определялись фагоцитирующие макрофаги. Ультраструктурные исследования показали, что в дальнейшем новообразованные коллагеновые волокна подвергались разрушению и резорбции макрофагами. Выявляющиеся среди коллагеновых волокон фибробласты были вакуолизированы, с разрушенной плазмолеммой.
На 21-30 сутки после введения частиц биоматериала в паренхиму печени крыс визуально отмечалось увеличение размеров печени и ее массы. Края органа закруглялись, он приобретал красноватый оттенок. На гистологических препаратах частицы биоматериала в паренхиме не обнаруживались. Междольковые сосуды становились спокойнее, явления стаза крови в них и холестаза в желчных протоках исчезали. Желчные протоки были интактной структуры. Признаки обратного развития цирроза проявлялись в истончении фиброзных прослоек между дольками и вокруг портальных трактов. Количество фибробластов и коллагеновых фибрилл в синусоидах заметно уменьшалось, а синусоидных клеток - возрастало. На ультраструктурном уровне выявлялся выраженный лизис коллагеновых волокон и резорбция их макрофагами. Коллагеновые фибриллы, выявляющиеся в пространстве Диссе, были с признаками лизиса. В синусоидах определялись разрушающиеся вакуолизированные фибробласты с разрушенными плазматическими мембранами. В эндотелиоцитах, как свидетельство улучшения трансэндотелиального обмена, отмечалось увеличение количества пиноцитозных пузырьков.
Прослеживалась тенденция восстановления паренхимы печени с образованием балок, хотя полиморфизм клеток в некоторых участках еще сохранялся, а общая структура паренхимы имела признаки атипичности: дольки были неодинаковых размеров с одной или двумя центральными венами, в большинстве случаев расположенных эксцентрично.
Электронно-микроскопически выявлялись признаки усиления функциональной активности гепатоцитов в виде гипертрофии ядрышек в ядре, гиперплазии митохондрий и канальцев гранулярного эндоплазматического ретикулума. В цитоплазме определялось большое количество свободных рибосом и полирибосом. В некоторых гепатоцитах появлялись гранулы и розетки гликогена.
В последующие 90 суток после введения биоматериала в печень крыс на гистологических препаратах печени выявлялись вышеупомянутые признаки восстановления структуры паренхимы. В отдаленные сроки после введения частиц биоматериала в паренхиму цирротически измененной печени (180 суток) местами сохранялись морфологические признаки некоторой атипичности паренхимы, проявляющиеся в эксцентричном расположении центральных вен или их присутствия в дольке в количестве двух. Однако, цирротические ложные дольки полностью исчезали, равно как и соединительнотканные прослойки.
Таким образом, после введения аллогенного биоматериала в цирротически измененную печень крыс в паренхиме возникают репаративно–восстановительные процессы, выражающиеся образом в увеличении количества, стимуляции активности печеночных макрофагов и в интенсивной пролиферации гепатоцитов. Все эти слагаемые приводят к инволюции цирротической соединительной ткани и к восстановлению структуры печени.
Результаты морфологического исследования печени крыс в шестой группе после предбрюшинного введения им фетальной ткани в начальные сроки (7 дней) показали, что степень некроза печеночных клеток и воспалительно-клеточной инфильтрации паренхимы, фиброза, дистрофии гепатоцитов, степень пролиферации эпителия желчных протоков были выражены почти в той же степени, что и при цирротических изменениях печени крыс. Толстые соединительнотканные тяжи пронизывали паренхиму печени. Довольно большие участки в паренхиме занимали воспалительные инфильтраты, состоящие из лимфоцитов, макрофагов и фибробластов. Выявлялись отек, очаговые кровоизлияния и изменения цвета печени, резкое расширение синусоидов, портальных сосудов и центральных вен, выраженный стаз в них элементов крови. Но на фоне признаков дистрофических изменений цитоплазмы гепатоцитов выявлялась выраженная гипертрофия их ядер. Многочисленные крупные гиперхромные ядра резко выделялись в отечной паренхиме печени. К 14 суткам явления отека паренхимы значительно уменьшались, в некоторых участках до полного исчезновения. Наблюдались процессы пролиферации эпителия желчных протоков. Гепатоциты в паренхиме печени располагались беспорядочно. Формирование печеночных балок отмечалось в основном в непосредственной близости от расширенных сосудов портального тракта и центральных вен. Выявлялось большое количество гипертрофированных гепатоцитов с большими ядрами. Электронно-микроскопически в таких клетках выявлялось большое ядро и цитоплазма с большим количеством митохондрий и гиперплазией гранулярного эндоплазматического ретикулума, свидетельствующих об интенсификации энергетических и синтетических процессов. Количество двуядерных гепатоцитов несколько увеличивалось. Определялись признаки активации Купферовских клеток, особенно вблизи соединительнотканных прослоек.
В последующие сроки (21-30 дней) в отдельных участках паренхимы печени отмечалось частичное восстановление балочной структуры. Через 3 месяца продолжались процессы восстановления балочной структуры. Большинство гепатоцитов были гипертрофированы с ядрами различных размеров. Состояние сосудов портальных трактов и центральных вен улучшалось, количество соединительной ткани вокруг них уменьшалось. В дальние сроки эксперимента (180 суток) структура печени частично восстанавливалась. Некоторые участки паренхимы соответствовали норме, но в отдельных зонах балочная структура не определялась, гепатоциты были разных размеров.
Таким образом, после предбрюшинного введения фетальной ткани при экспериментальном циррозе в паренхиме печени возникали репаративно–восстановительные процессы, выражающиеся главным образом в гипертрофии и гиперплазии гепатоцитов. Значительным и основным фактором в восстановлении паренхимы являлась полиплоидия печеночных клеток, выражающаяся в увеличении размеров ядер гепатоцитов и гипертрофии самих клеток. Соединительнотканные тяжи между печеночными дольками к концу эксперимента исчезали не полностью, что свидетельствовало о частичном восстановлении структуры печени.
На 7 сутки после предбрюшинной имплантации фетальной ткани и введения в цирротически измененную печень крыс диспергированного биоматериала (седьмая группа опытов), последний определялся в печени в виде частиц различной величины. Они были инфильтрированы относительно небольшим количеством мононуклеарных клеток. Лимфоциты встречались среди них очень редко, плазматические клетки не определялись. Биоматериал подвергался интенсивной деколлагенизации и лизису. Частицы биоматериала активно резорбировались макрофагами. В окружающей паренхиме воспалительная реакция была слабо выраженной: незначительный отек и инфильтрация единичными лейкоцитами, сосудистый стаз. Обращало на себя внимание появление в окружающих сосудах и расширенных синусоидах значительного количества моноцитов со светлой цитоплазмой и темным овальным или бобовидным ядром. Особенностью являлось их диффузное распределение в паренхиме. В синусоидах определялось множество активно фагоцитирующих клеток Купфера.
В этот же срок эксперимента заметно увеличивалось количество двуядерных клеток в паренхиме печени, а также наблюдали выраженные признаки регенераторной активности в виде гипертрофии гепатоцитов. Гипертрофированные гепатоциты имели крупные ядра, в которых четко просматривались одно или два ядрышка, богатые гранулярным веществом. Паренхима печени состояла из чередующихся участков, состоящих из полиморфных гепатоцитов с выраженными признаками дистрофических изменений цитоплазмы, и участков с регенерирующими мелкими гепатоцитами с розовой ровно окрашивающейся цитоплазмой. Электронно-микроскопически в гипертрофированных клетках выявлялись гранулярный эндоплазматический ретикулум и митохондрии, хотя указанная сеть была мелковакуолярно расширена, заполнена содержимым средней электронной плотности и умеренно дегранулирована. Она плотными слоями располагалась вокруг ядра. На ультраструктурном уровне во многих участках паренхимы печени в синусоидах и в перисинусоидальном пространстве выявлялся лизис отдельных коллагеновых волокон.
Спустя 14 суток в паренхиме печени частицы биоматериала уже не обнаруживались, вместо них выявлялись небольшие участки рыхлой новообразованной соединительной ткани, окрашивающейся по Ван-Гизону в нежно-розовый цвет, между которыми небольшими островками располагались группы мелких гепатоцитов с равномерно окрашивающейся цитоплазмой и небольшими, одинаковых размеров, ядрами. В этих группах клеток определялись фагоцитирующие макрофаги. По всей паренхиме продолжали обнаруживаться участки с пролиферирующими гепатоцитами. Количество двуядерных гепатоцитов увеличивалось (рис. 10). На 21-30 сутки после опыта на макроскопическом уровне отмечалось увеличение размеров печени и ее массы. На гистологических препаратах частицы биоматериала в паренхиме печени не обнаруживались. Выявлялись признаки пролиферации эпителия желчных протоков. Признаки обратного развития цирроза проявлялись в истончении фиброзных прослоек между дольками и вокруг портальных трактов макрофагами. В паренхиме гепатоциты выстраивались в балочные структуры (рис. 11), хотя полиморфизм клеток в некоторых участках еще сохранялся, а общая структура паренхимы имела признаки атипичности: дольки были неодинаковых размеров с одной или двумя центральными венами, в большинстве случаев расположенных эксцентрично.
В течение последующих 90 суток после введения биоматериала в печень крыс и стимуляции фетальными тканями на гистологических препаратах печени выявлялись все вышеупомянутые признаки восстановления структуры паренхимы. Соединительнотканные прослойки между дольками почти полностью исчезали, а те, которые еще сохранились, были сильно истончены, что едва определялись. К 90 суткам восстанавливалась структура желчных протоков, кровеносных сосудов портальных трактов. Большинство шунтирующих сосудов спадались и редуцировались. 
Рис. 10. Относительное количество двуядерных гепатоцитов, %
Через 180 суток после введения частиц биоматериала в паренхиму цирротически измененной печени и предбрюшинного введения фетальной ткани в печени местами сохранялись морфологические признаки некоторой атипичности паренхимы, проявляющиеся в эксцентричном расположении центральных вен или их присутствия в дольке в количестве двух. Однако, цирротические ложные дольки полностью исчезали, также как и фиброзные тяжи между печеночными дольками. Вокруг портальных трактов и центральных вен обнаруживались полностью сформированные печеночные балки с типичной структурой составляющих их гепатоцитов (рис. 12).
Таким образом, после введения в цирротически измененную печень диспергированного биоматериала и предбрюшинной имплантации фетальной ткани в паренхиме печени возникали репаративно–восстановительные процессы, выражающиеся как в интенсивной пролиферации гепатоцитов, так и в гипертрофии и полиплоидизации ядер гепатоцитов. Гипертрофия и полиплоидизация ядер гепатоцитов преобладала в начальные сроки эксперимента (7-14 суток). В дальнейшие сроки превалировали процессы пролиферации печеночных клеток. Стимуляция аллогенным биоматериалом и фетальными тканями приводит к активации печеночных макрофагов, которые резорбируют коллагеновые волокна, в результате чего цирротическая соединительная ткань между печеночными дольками подвергается инволюции. Через полгода структура печени крыс восстанавливается.
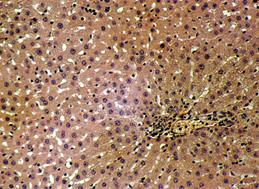
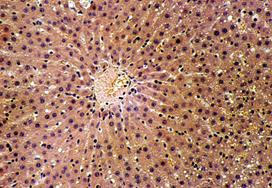
Рис. 12. Сформированные балочные структуры гепатоцитов вокруг центральной вены в печени крысы на 180 сутки после стимуляции аллогенным биоматериалом и фетальными тканями. Окраска по Ван Гизону. Увел.Х125.
Результаты исследования функционального состояния печени в экспериментеПо окончании введения тетрахлорметана у крыс выявлено повышение уровня общего билирубина и активности аминотрансфераз сыворотки крови. Через 30 дней после прекращения введения тетрахлорметана и стимуляции регенерации печени у всех животных в наблюдаемых группах произошла частичная нормализация показателей билирубина и трансаминаз, нарушенных в результате цирроза, но активность этого процесса была различной (рис. 13-15).
Через 180 дней после прекращения введения тетрахлорметана и стимуляции регенерации в 5, 6 и 7 группах биохимические показатели сыворотки крови у подопытных животных практически нормализовались. В 3 и 4 группах происходило снижение билирубина и гиперферментемии в периферической крови, однако полной нормализации показателей и устранение гиперферментемии не происходило.
Таким образом, проведенное экспериментальное исследование позволяет аргументированно утверждать, что совместное применение аллогенного биоматериала и фетальной ткани оказывает стимулирующее влияние на репаративные процессы при цирротическом поражении печени.
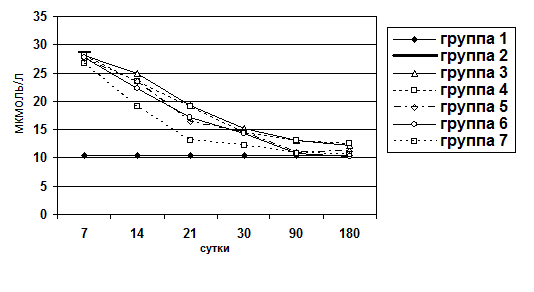
Рис. 13. Изменение показателя билирубина в процессе эксперимента. 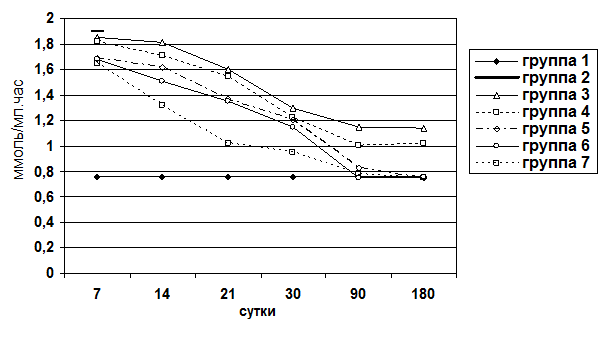
Рис. 14. Изменение показателя активности АсАТ. 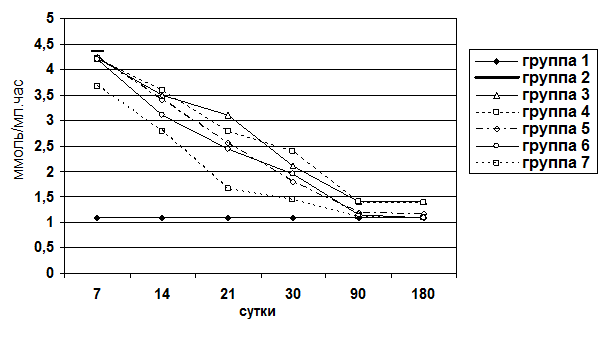
Рис. 15. Изменение показателя активности АлАТ
Стимуляция регенерации печени этим методом в морфофункциональном отношении эффективнее, чем при отдельном введении биоматериала и фетальной ткани.
Проведенные экспериментальные исследования позволили начать клиническое применение данной методики. Сочетанное введение аллогенного диспергированного биоматериала и фетальной ткани печени человека применили у одного больного с субкомпенсированным циррозом печени неуточненной этиологии, осложненным портальной гипертензией I ст., варикозным расширением вен пищевода I ст. Анализ результата лечения (обследован через 6, 12 и 18 месяцев) указывает на достижение стабильной ремиссии заболевания. Прослеживается значительная положительная динамика в степени выраженности как астеновегетативного синдрома (повысился эмоциональный тонус, работоспособность, уменьшились симптомы общей интоксикации), так и клинических проявлений печеночной недостаточности (нормализация по биохимическим, иммунологическим и инструментальным данным). К сожалению, единичное клиническое наблюдение не позволяет нам обобщить эти данные в отдельную главу данной работы.
Заключение и практические рекомендации
После введения аллогенного биоматериала в цирротически измененную печень крыс происходит активация макрофагов печени и увеличение их количества, что приводит к резорбции избыточной соединительной ткани, восстановлению микротопографических взаимоотношений в ацинусе и созданию условий для пролиферации гепатоцитов.
При предбрюшинном введении фетальной ткани при экспериментальном циррозе печени основным фактором регенерации является полиплоидия печеночных клеток и их гипертрофия, что приводит к раннему восстановлению функциональных показателей печени.
При сочетанном применении диспергированного биоматериала и фетальной ткани происходит потенцирование влияния обоих материалов, выражающееся в резорбции избыточной соединительной ткани, пролиферации и полиплоидизации гепатоцитов, восстановлении структуры и массы органа, а также в раннем восстановлении функциональных показателей печени.
Положительные результаты экспериментов позволяют рекомендовать клиническое применение фетальной ткани печени в сочетании с аллогенным диспергированным биоматериалом в комплексном хирургическом лечении больных с хроническими активными гепатитами и циррозами печени.
Практические рекомендации
В комплекс хирургического лечения хронических гепатитов и циррозов печени целесообразно включить предбрюшинную имплантацию фетальной ткани печени и посегментарное введение в паренхиму печени аллогенного биоматериала.
Фетальную ткань печени необходимо вводить в предбрюшинную клетчатку круглой связки печени путем ее пункции на середине расстояния между мечевидным отростком и пупком в дозе 8×107 живых клеток в 5 мл физиологического раствора.
Аллогенный диспергированного биоматериал необходимо вводить в доступные сегменты печени безигольным инъектором в дозе 10 гр. материала в 30 мл 0,25_% новокаина.
Литература
-
Влияние фетальных тканей печени и биоматериала Аллоплант на регенеративные процессы при экспериментальном циррозе печени / М.А. Нартайлаков, Р.С. Мингазов, И.В. Янгиров, С.А. Муслимов, Л.А. Мусина, А.Н.Батанов // Морфологические ведомости. - 2006. - № 1-2. – Прил. № 1. –– С. 207-211.
-
Возможности хирургического лечения эхинококкоза печени / В.С. Пантелеев, Д.Р. Мушарапов, В.Г. Хисамов, Э.Р. Даукаева, И.В. Янгиров // Вопросы теоретической и практической медицины: тез. докл. 66-й Респ. науч. конф. студентов и молодых ученых БГМУ. – Уфа, 2001. – Т. 1 – С. 122–123.
-
Клинико-экспериментальное обоснование стимуляции регенерации печени при хронических активных гепатитах и циррозах // М.А. Нартайлаков, Э.Р. Мулдашев, Р.С. Мингазов, И.А. Сафин, С.А. Муслимов, Л.А. Мусина, Г.Р. Ахиярова, И.В. Янгиров // Здравоохранение Башкортостана. - 2004. - № 3: Новые технологии в хирургии. – С. 211-212.
-
Стимуляция регенерации печени при ее диффузных заболеваниях / М.А. Нартайлаков, И.В. Янгиров, Р.С. Мингазов, А.Н. Батанов // V съезд научного общества гастроэнтерологов России и XXXII сессия Центрального научно-исследовательского института гастроэнтерологии Департамента здравоохранения г. Москвы. Тезисы. – М., 2005. – С. 158.
-
Стимуляция регенерации печени при хронических гепатитах и циррозах / И.В. Янгиров, М.А. Нартайлаков, Р.С. Мингазов, А.Н. Батанов // Неотложная и специализированная хирургическая помощь: тез. докл. 1-го конгресса московских хирургов. - М.: ГЕОС, 2005. – С. 315.
-
Фетальная ткань и стимулятор регенерации - Аллоплант в лечении хронических гепатитов и циррозов печени в эксперименте / М.А. Нартайлаков, И.В. Янгиров, Р.С. Мингазов, С.А. Муслимов, Л.А. Мусина, А.Н.Батанов // Здравоохранение Башкортостана. – 2006. - №1: Труды ассоциации хирургов Республики Башкортостан за 2005 год. – С. 19-26.
к содержанию | опубликовать статью
СТИМУЛЯЦИЯ РЕГЕНЕРАЦИИ И КОРРЕКЦИЯ МИКРОЦИРКУЛЯЦИИ ЖЕЛУДКА И ДВЕНАДЦАТИПЕРСТНОЙ КИШКИ ПРИ ЛЕЧЕНИИ ЯЗВЕННОЙ БОЛЕЗНИ
Даутов С. Б.
ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Автором в экспериментальных и клинических исследованиях внедрены новые методические приемы исследования органной микроциркуляции при язвенной болезни желудка и двенадцатиперстной кишки с использованием лазерной допплеровской флоуметрии. Разработаны и внедрены в клиническую практику методы хирургического лечения язвенной болезни с применением аллогенных стимуляторов Аллоплант, и методов защиты анастомозов аллогенным гемостатическим и герметизирующим препаратом «Аллогем».
Актуальность
Несмотря на широкое внедрение в медицину патогенетически обоснованных методов лечения язвенной болезни желудка и двенадцатиперстной кишки, проблема лечения больных с данной патологией остается актуальной. В последнее десятилетие отмечается устойчивый рост заболеваемостью язвенной болезни желудка и двенадцатиперстной кишки, особенно среди лиц трудоспособного возраста, растет число осложненных форм болезни (Буянов В.М., 1997; Кузин М.И., 1998). При этом проблема лечения больных язвенной болезнью желудка и двенадцатиперстной кишки в значительной степени остается хирургической (Савельев В.С. и др.,1998; Debas Н.Т., 1999).
Несмотря на сложность и многофакторность патогенеза язвенной болезни желудка и двенадцатиперстной кишки, большинство исследователей склоняется к тому, что ведущим фактором патогенеза и хронизации язвенного повреждения слизистой оболочки являются микроциркуляторные нарушения. Отмечено, что действие различных альтерирующих факторов, в том числе микробных, нейрогуморальных и т.д., в первую очередь оказывает негативное влияние на состояние микроциркуляторного русла желудка и двенадцатиперстной кишки (Брискин Б.С., Алиев И.М., 1999; В1аzег М.J.,1998). Получены прямые экспериментальные и клинические данные, показывающие, что состояние органного кровотока прямо коррелирует с процессом заживления язвы (Сахаутдинов В.Г., Тимербулатов В.М., Хасанов А.Г., 1997; Григорьев П.Я., 1997). Между тем, в диагностическом арсенале, как хирургов, так и терапевтов - гастроэнтерологов, отсутствуют простые и информативные приемы контроля за состоянием микроциркуляторного звена кровообращения желудка и двенадцатиперстной кишки. Отдельной проблемой, как в терапевтических, так и в хирургических аспектах остается стимуляция регенерации при рубцевании язвы и при заживлении анастомозов (Логинов А.С, 1998). Существующие методы лекарственной терапии, лазеротерапии и т.д. по мнению ряда авторов, не обладают пролонгированным эффектом и не обеспечивают стойкой ремиссии язвообразования.
Общепризнанно, что классическая резекция желудка в подавляющем большинстве случаев обеспечивает стойкое выздоровление больного, предотвращает развитие рецидива язвы и позволяет отказаться от приема лекарственных препаратов, значительно улучшая качество жизни пациента (Шалимов А.А. и др., 1987; Черноусов А.Ф. и др., 1998). Однако развитие пострезекционных осложнений и болезней резецированного желудка в последние годы ограничивает показания к применению данного вида лечения, при этом часто отдается предпочтение органосохраняющим операциям (Панцырев Ю.М., 1995, Кузин М.И.,1998). Поэтому разработка и совершенствование методов хирургического лечения язвенной болезни желудка и двенадцатиперстной кишки остается актуальной проблемой современной хирургии.
В связи с вышеизложенным представляется актуальным поиск путей улучшения результатов хирургического лечения больных язвенной болезнью желудка и двенадцатиперстной кишки, направленных на стимуляцию регенерации и восстановление органной микроциркуляции.
Целью данной работы является улучшение результатов консервативной терапии и хирургического лечения язвенной болезни желудка и двенадцатиперстной кишки путем разработки методов стимуляции регенерации и коррекции микроциркуляции органов гастродуоденалъной зоны.
Материалы и методы исследований
Для решения поставленных задач проведен комплекс экспериментальных и клинических исследований. В экспериментальных исследованиях было использовано 75 белых крыс- самцов линии "Вистар" весом 180 - 220 гр. Оперативные вмешательства выполняли под барбитуровым (40 мг/кг веса) и калипсоловым наркозом, болезненные процедуры - под эфирным рауш - наркозом. Животных содержали в условиях вивария на свободном пищевом режиме.
Хроническую язву желудка у крыс моделировали по способу Р. Okabi и S. Pfeiffer. Для этого стенку желудка в антральном отделе наносили каплю (до 0,5 мл) концентрированной уксусной кислоты. Через 7-10 дней образовывалась язва, морфологически сходная с язвой у человека, имеющая форму клина, обращенного вершиной кнаружи. Язва частично заживает самостоятельно в течение 5-7 мес. Данная методика общепризнанна и апробирована многими исследователями (Аруин Л.И. и др., 1980; Шалимов С.А и др., 1989). Релапаротомии выполнялись в сроки 7, 14, 30, 60, 120, 180 суток для проведения морфологических и физиологических исследований.
Во второй серии экспериментов исследовали динамику регенерации при использовании аллогенного стимулятора регенерации Аллоплант. Для этого в момент первой релапаротомии аллотрансплантат вводился путем инъекций в края язвы со стороны слизистой. Во время следующих релапаротомии, выполненных серийно с интервалом 7 суток (всего 5 эпизодов введения) аллотрансплантат вводился в края язвы со стороны серозной поверхности.
В третьей серии экспериментов крысам выполняли резекцию 2/3 желудка по Бильрот-2 с формированием гастроеюноанастомоза на короткой петле. Анастомоз формировали двухрядным узловым швом с использованием шовного материала дексон и максон 5/0.
В четвертой серии опытов резекция желудка по Бильрот-2 была выполнена с формированием однорядного гастроеюноанастомоза тем же шовным материалом.
В пятой серии экспериментальных исследований после формирования однорядного гастроэнтероанастомоза его поверхность перитонизировали муфтой из аллотрансплантата «Аллогем», изготовленного из аллогенной брюшины и обработанного компонентами фибринового клея.
В шестой серии экспериментов анастомоз формировали бесшовным методом, используя для склеивания раневых поверхностей аллотрансплантат «Аллогем» с адгезивными и перитонизирующими свойствами.
Контрольную группу составили 10 животных, которым была выполнена только лаларотомия и серийные релапаротомии по срокам исследования.
Биохимические лабораторные исследования проведены на полианализаторе EYSYS фирмы BOEHRIGER MANNYEIM с использованием реактивов той же фирмы.
Биологическая проницаемость анастомоза была изучена методами микробиологических исследований. При оперативном вмешательстве проводили кантоминацию культурой золотистого стафилококка (музейный штамм кафедры микробиологии Башкирского медицинского университета). Для этого в желудок крысы помещали желатиновую капсулу с 10 микроорганизмами. В контрольные сроки с линии анастомозов делали смывы, либо в стерильных условиях забирали поверхностные участки перитонизируюшего препарата «Аллогем». Всего проведено 50 опытов.
Морфологические исследования были проведены по общепринятым методам, препараты окрашивали гематоксилин-эозином, бриллиантовым синим и фуксином, по Ван-Гизон, соединительную ткань исследовали с помощью трехцветной окраски по Маллори. Морфологическую структуру микро-циркуляторного русла изучали методом импрегнации азотнокислым серебром по В.В. Куприянову. Всего гистологическому исследованию подвергнуто 1500 препаратов.
Для изучения ультраструктуры биопсийный материал предфиксировали в 2,5 % растворе глютарового альдегида с последующей фиксацией в 2 % растворе осмиевой кислоты на фосфатном буфере рН 7,2 - 7,4. Препараты обезвоживали в батарее спиртов, ультратонкие срезы толщиной 0,3 - 0,5 мкм готовили на ультратоме LKB, контрастировали напылением золота и препараты просматривали под электронным микроскопом JEM - 7А (JEOL, Япония) при инструментальном увеличении от 7,5 до 30000 раз.
С целью стимуляции регенерации при консервативном лечении язвенной болезни и перитонизации анастомозов при резекциях был применен аллотрансплантат Аллоплант, разработанный во Всероссийском центре пластической хирургии глаза (директор - профессор Мулдашев Э.Р.).
Аллотрансплантаты серии Аллоплант изготавливаются согласно ТУ 42-2-537-87, разрешены к применению в клинической практике приказом МЗ СССР № 87 901 - 87 от 22. 07. 1987 года.
Ранее было замечено, что при применении нативных аллотрансплантатов в течение 10-15 дней наблюдается выраженная иммунная реакция в виде отека, гиперемии и инфильтрации лимфоцитами, нейтрофила-ми, макрофагами и др. клетками, затем она стихает, что связано с экстракцией гликозаминогликанов из коллагеновых волокон; как только гликозами-ногликаны экстрагировались из коллагеновых волокон в межклеточное вещество, так начиналось стихание иммунной реакции (Мулдашев Э.Р., 1995). При исследовании процессов замещения аллотрансплантатов Аллоплант было открыто два типа регенерации тканей реципиента: регенерация рубцовой ткани и регенерация натуральной ткани реципиента. При этом аллотрансплантат служит "каркасом" для формирования регенерата тканей реципиента.
В работе были использованы следующие биологические препараты серии Аллоплант:
1 - трансплантат - стимулятор регенерации представляет собой мелкодисперсный порошок, изготовленный из соединительнотканных образований путем диспергирования. Перед использованием порошок смешивается с физиологическим раствором и вводится с помощью иньектора по каналу эндоскопа в край язвы.
2 - аллотрансплантат «Аллогем» с перитонизирующим эффектом был применен для защиты анастомозов. Данный препарат приготовлен из аллогенной брюшины, обработан компонентами фибринового клея, при применении он проявляет стойкую адгезию к серозным поверхностям желудочно-кишечных анастомозов.
Все аллотрансплантаты тестируются на вирусные гепатиты В и С, ВИЧ - инфекцию, проходят гамма - стерилизацию, срок хранения - 5 лет.
Проблема микроциркуляции и возможность тестирования микроцирку-ляторных расстройств является важной и актуальной как в теоретическом, так и практическом отношениях. Тем не менее, отсутствие методических приемов оценки тканевого кровотока до последнего времени затрудняло изучение микроциркуляции в эксперименте, и особенно в клинике. Качественный прогресс в этой области начался в 1980 г. с разработки R. Bonner метода лазерной допплеровской флоуметрии. Метод основывается на том, что отраженный от статических компонентов лазерный сигнал не изменяет своей частоты, а отраженный от подвижных частиц - имеет допплеровское смещение относительно зондирующего сигнала, что позволяет определить скорость движения эритроцитов в зондируемом объеме тканей. Колебания кровотока, называемые еще осцилляциями или флаксмоциями (flux motion), периодически происходят в тканях, отражая важнейшую характеристику их жизнедеятельности: изменчивость и приспосабливаемость кровотока к постоянно меняющимся условиям гемодинамики и потребностям тканей в перфузии их кровью.
Лазерный допплеровский флоуметрический (ЛДФ - грамма) сигнал регистрируется от объема тканей около 1 кубического мм. В этом объеме содержится порядка 200 микрососудов, в которых единовременно находится 3,5x10 эритроцитов. Поэтому отраженный лазерный сигнал, характеризуя перфузию тканей кровью, отражает совокупные процессы, протекающие во всех микрососудах, находящихся в зоне измерения. Ритмические колебания кровотока и их изменения позволяют получить информацию об определенных соотношениях различных механизмов, определяющих состояние микроциркуляции. Нами в эксперименте и клинике использован отечественный лазерный анализатор капиллярного кровотока ЛАКК-01. В качестве датчика анализатора применяется световодный зонд, выполненный из трех моноволокон. Одно используется для доставки лазерного излучения из прибора к исследуемой ткани, два других являются приемными рассеянного тканью лазерного излучения. Доставленный по волокнам сигнал анализируется, после аналоговой обработки формируется выходной сигнал, пропорциональный первому моменту мощности спектральной плотности допплеровского сдвига частоты или произведению сомножителей: скорости движения эритроцитов и их концентрации в зондируемом объеме.
Лазерный анализатор кровотока разрешен Минздравом РФ для применения в практическом здравоохранении (Протокол № 1 от 13.01.1993 г. Комиссии по клинико-диагностическим приборам).
Основным изучаемым параметром является показатель микроциркуляции (ПМ), другой важной характеристикой ЛДФ-сигнала является среднее квадратичное отклонение (СКО), которое в большей мере характеризует величину колебаний кровотока в тканях (флаксмоции). Среди флаксмоций выделяют различные ритмические составляющие, которые характеризуются амплитудой (А) и частотой (F). В физиологическом плане наибольший интерес представляют низкочастотные колебания кровотока (LF) от 4 до 10-12 колебаний в минуту, обусловленные вазомоторной активностью; высокочастотные флаксмоции (HF) от 12 до 30 колебаний в минуту, связанные с дополнительным включением механизмов активации крови из микроциркуля-торного русла за счет дыхательных экскурсий (в норме он выражен слабо); и флаксмоции в области кардиоритма - от 50 до 90 колебаний в мин. Определенный интерес представляет собой низкочастотный ритм, более медленный, чем вазомоторный, это так называемый альфа-ритм, обусловленный ритмическими контракциями эндотелиоцитов. Оценивается также сосудистый тонус (СТ) и эффективность микроциркуляции (ЭМ).
В.И. Козловым выявлены три типа амплитудно-частотного спектра, характеризующиеся различной амплитудой вазомоторных колебаний. Первый тип спектра характерен для ламинарного кровотока, остальные два типа возникают при нестабильной перфузии, что обусловлено повышенной лабильностью сосудистого тонуса артериол. На основе выявленных особенностей предложена физиологическая классификация его нарушений: физиологическая норма, спастическая, спастико-атоническая, застойная и стазическая формы. Нами анализатор использовался как в экспериментальных, так и клинических исследованиях для оценки динамики регенераторного процесса, тяжести осложнения, эффективности лечения. Аппарат применялся интраоперационно и в блоке с фиброэндоскопом.
Клинический материал представляет анализ результатов лечения и обследования 991 больного язвенной болезнью желудка и двенадцатиперстной кишки, находившихся в Республиканской клинической больнице им. Г.Г.Куватова (отделения терапевтической и хирургической гастроэнтерологии), в период с 1995 по 1999 годы.
Оперативному лечению подвергнуто абсолютное большинство больных, 565 пациентов оперировано в плановом порядке, 279 - по экстренным и срочным показаниям.
Оперированные больные находились в возрасте от 18 до 82 лет. Средний возраст составил 45,6 ± 10,2 лет. Из числа оперированных 602 (82,6 %) были мужчинами и 242 (17,4 %) - женщинами. Резекция желудка в различных модификациях выполнена у 615 (79,1 %), прочие операции, в основном дренирующие с различными видами ваготомий у 229 (20,1 %) больных. Из 615 больных, перенесших резекцию желудка, 444 (72,2 %) были оперированы по поводу язвенной болезни двенадцатиперстной кишки и 96 (15,6 %) - по поводу язвенной болезни желудка, 63 (10,2 %) - по поводу язв двойной локализации и 12 (2,0 %) по поводу постгастрорезекционных синдромов. Среди больных, перенесших резекцию желудка, большую часть (92,6 %) составили больные с осложненными формами язвенной болезни желудка и двенадцатиперстной кишки. У 7,"4 % больных, имевших неосложненное течение язвенной болезни, отмечался выраженный болевой синдром и частые рецидивы. Из данной группы больных оперировано 29,2 % больных, показанием служило отсутствие эффекта и рецидив язвы после комплексной консервативной терапии с применением аллогенного стимулятора регенерации Аллоплант.
Обследование больных проводилось в лабораторно-диагностических подразделениях вышеуказанной клиники. После оперативного лечения больные находились под наблюдением в течение 3 лет, периодически являясь на контрольные обследования.
Больным язвенной болезнью желудка и двенадцатиперстной кишки проводилось комплексное обследование, включающее клинические, инструментальные и специальные методы исследования.
Эндоскопические методы исследования заключались в проведении фиброэзофагогастродуоденоскопии, при которой определялась локализация язвы, ее размеры и глубина, наличие осложнений, состояние слизистых оболочек пищевода, желудка и двенадцатиперстной кишки, наличие дуоденогастрального и гастроэзофагеального рефлюксов.
Блок рентгенографических исследований выполнен по стандартным принципам.
С целью установления роли Helicobacterpyloriв патогенезе расстройств микроциркуляции при язвенной болезни были проведены биохимические и морфологические (электронная микроскопия) методы их идентификации.
Для оценки микроциркуляции органов гастродуоденальной зоны был применен описанный выше метод лазерной допплеровской флоуметрии.
Наряду с физиологическими, были применены морфологические методы оценки микроциркуляции - изучение терминальных сосудов серозных оболочек с учетом того, что морфологическое состояние микроциркуляторного русла оболочек достаточно полно отражает состояние кровеносных сосудов самого органа.
Наряду с традиционными методами статистической обработки результатов, предусматривающими определение среднеарифметических параметров и ошибок определения, параметрических и непараметрических методов статистики, были использованы специальные методы обработки результатов с помощью пакета прикладных программ Statgraphics: корреляционный по Спирмену и факторный анализ по способу главных компонент.
Результаты исследования и их обсуждение
Экспериментальная часть
Эксперименты с моделированием хронической язвы желудка показали, что ее развитие сопровождается глубокими нарушениями микроциркулятор-ного звена серозной оболочки желудка. При моделировании язвы в области воздействия уксусной кислоты к 14 суткам образовывалась зона коагуляци-онного некроза, которая к периферии сменялась зоной с нарушением целостности микроциркуляторного русла и внутрисосудистой коагуляции крови. По мере удаления от фокуса повреждения тканей последовательно располагались зоны с микроциркуляторным стазом, дисфункциональной дилятацией микрососудов и замедлением кровотока с признаками усиления агрегатных свойств крови, перифокальной гиперемией и, наконец, с неизмененной микроциркуляцией. Необратимыми были изменения в зоне некроза и прилегающей к ней зоне коагуляции крови.
Таким образом, при экспериментальном моделировании язвенного дефекта состояние микроциккуляции по направлению от центра к периферии (неизмененным тканям) имеет зональное распределение, причем зоны последовательно сменяют друг друга, частично перекрывая. Первая зона -зона некротических изменений и нарушений целостности микроциркуляторного русла располагается непосредственно по краю язвы. Вторая зона-дисфункциональной дилятации всех звеньев микроциркуляции - представляла кольцо, шириной 3-5 мм, по краю язвы. Третья зона - зона умеренных нарушений микроциркуляции характеризовалась спазмом артериол, дилятацией венул, нарушением лимфатического дренажа тканей. Ранее аналогичные зоны нарушений микроциркуляции желудка были описаны В.И.Козловым при лазерной коагуляции.
Исследования микроциркуляции методом лазерной допплеровской флоуметрии показали, что моделирование язвенного дефекта резко ухудшает показатели микроциркуляции в области язвы, причем исследование микроциркуляторного русла аппаратом ЛАКК-01 прямо коррелирует с морфологическими данными, полученными при исследовании препаратов желудка и двенадцатиперстной кишки, импрегнированных азотнокислым серебром по В.В.Куприянову и данным биомикроскопии (в собственной модификации метода). Так, в первой зоне ЛДФ-грамма и амплитудно-частотный спектр колебаний кровотока соответствует стазической форме нарушений микроциркуляции. Изменения микроциркуляции второй зоны сопровождаются как снижением показателя микроциркуляции, так и снижением показателя эффективности микроциркуляции. При этом спектр Фурье-преобразования соответствовал застойной форме. Однако, в некоторый участках данной зоны наблюдались участки спастико-атонической формы ЛДФ-граммы, морфологически соответствующие зонам микроциркуляции с выраженным спазмом артериол. Третья зона - зона умеренных нарушений микроциркуляции характеризовалась спазмом артериол, дилятацией венул, нарушением лимфатического дренажа тканей. Изменения ЛДФ-граммы характеризовались как спастическая форма, и носили, по-видимому, компенсаторно-приспособительный характер, препятствуя процессам аутоинтоксикации.
Данные изменения микроциркуллции прямо коррелируют с регенераторными процессами. Динамика показателя микро циркуляции показывает на его стабильно низкие значения в первой и второй зонах во все сроки наблюдения, что, очевидно, отражается на степени выраженности репаративных процессов. Вероятно, усиление микроциркуляции в третьей зоне со «сдвигом» ее в направлении центра язвы служит как пролиферативным стимулом, так и базисом для обеспечения регенерации.
По-видимому, блок микроциркуляции в первой и второй зонах способствует, с одной стороны, уменьшению аутоинтоксикации за счет снижения всасывания продуктов распада. Но, с другой стороны, сосудистая изоляция язвенного дефекта ограничивает поступление в кровоток и в интерстициаль-ное пространство местных факторов стимуляции регенерации (эпидермальмый фактор роста, мезенхимальные факторы и т.д.).
Во второй серии экспериментов на 15 белых крысах-самцах линии «Вистар» на 14, 30 и 45 сутки в края язвенного дефекта вводили аллогенный аллотрансплантат - стимулятор регенерации Аллоплант, преимущественно во вторую зону нарушений микроциркуляции.
Ранее было исследовано влияние интерстициального введения данного препарата на микрососудистые процессы, установлены механизмы его резорбции (Нартайлаков М.А.,1995 - 1999). В частности, было установлено, что тотчас после применения аллотрансплантат включается в процессы транскапиллярного обмена с тканевым ложем, обладая способностью циркуляции в бессосудистых условиях. Первая стадия была названа стадией дососудистой циркуляции. В дальнейшем трансплантат прорастает сосудами и происходит его резорбция, сопровождающаяся интенсивной макрофагальной инфильтрацией, с регенерацией собственных тканей донора по соединительнотканному каркасу трансплантата.
В первую стадию (дососудистой циркуляции), продолжающейся до 3 суток, применение аллотрансплантата не оказало достоверных изменений показателей микроциркуляции. Однако, введение Аллопланта изменило состояние лимфодренажа тканей в области язвы. Для оценки изменений лимфодренажа мы использовали метод «красящего пятна», основанный на скорости элиминации красителя синего Эванса. Известно, что при интерстициальном введении данный краситель плотно связывается с тканевыми белками крови и его транспортировка происходит исключительно по лимфатическим путям.
При диффузном введении Аллопланта в края язвенного дефекта происходят, прежде всего, изменения в микролимфоцикуляторном русле, связанные с усилением лимфатического дренажа тканей, а сам препарат обладает выраженным лимфопротекторным эффектом. По-видимому, изменение структуры препарата, связанное с дозированной элиминацией гликозаминогликанов из коллагеновых волокон трансплантата, лишает последнего феномена стерического ограничения макромолекул основного вещества соединительной ткани (Андриянов А.Н., 1991). Это приводит к тому, что пространство аллотрансплантата становится доступным для циркуляции интерстициальной жидкости по градиентам онкотического и гидростатического давления. При витальной микроскопии видно, что, окрашенные синим Эванса потоки интерстициальной жидкости ориентируются соответственно направлениям коллагеновых волокон в частицах аллотрансплантата. Аллоплант, представляющий собой бессосудистое соединительно-тканное образование, имеет пути дососудистой циркуляции, являющиеся фактически прелимфатиксами.
В настоящее время признано, что движущей силой лимфообразования и лимфотока является сократительная активность лимфангиона. Однако в первые 3 суток аллотрансплантат представляет образование, лишенное клеточных элементов, следовательно, потоки жидкостей в нем можно описать законами Старлиига. Согласно полученным данным, в течение первого часа после введения аллотрансплантата в край язвы происходит обширная гидратация трансплантата, развивается отек препарата и прилежащего участка стенки желудка. При этом на транскапиллярный обмен наиболее существенно влияют следующие факторы:
- проходимость воды через стенку кровеносных капилляров (коэффициент капиллярной фильтрации);
- давление фильтрации (осмотическое и гидростатическое);
- осмотическое давление коллоидов интерстициальной жидкости;
- способность стенок капилляров пропускать белки.
Притягивая и полусвязывая воду, коллагеновые и элластические волокна Аллопланта вызывают его набухание, при этом резко падает гидростатическое давление внутри препарата.
Однако в дальнейшем превышение внешнего давления над давлением набухания ведет к высвобождению воды и ее выжиманию из аллотрансплантата и резорбции как в венозную, так и лимфатическую систему. Главные качественные изменения транскапиллярного обмена в аллотрансплантате, рассматривающиеся по оси «большая кривизна - малая кривизна», заключаются в следующем:
- падение интерстициального гидростатического давления, ведущее к оттоку жидкости в трансплантат;
- умеренный рост коэффициента капиллярной фильтрации;
- увеличение градиента давления и фильтрации жидкости через Аллоплант.
Таким образом, уже в первые сутки после внедрения в край язвы Аллоплант обладает определенной функциональной активностью, связанной с лимфогенными механизмами ультрациркуляции, что обеспечивает в дальнейшем его хорошее приживление.
Морфологические исследования показали, что, начиная с трех суток после инъекции, частицы Аллопланта инфильтрируются клеточными элементами: нейтрофилами, фибробластами и макрофагами, прорастают новообразованными сосудами, идет образование капиллярных и лимфатических сетей. Воспалительная реакция во всех случаях выражена умеренно. К 10 -15 суткам после инъекции препарата начинаются процессы его резорбции, связанные, прежде всего, с макрофагальной инфильтрацией и, по-видимому, активацией лизосомных ферментов. Улучшение показателей микроциркуляции в эти сроки, протекающие на фоне заживления язвенного дефекта, можно объяснить тем, что при резорбции аллогенного трансплантата образуются факторы роста. Другим фактором, улучшающим микроциркуляцию, может быть резорбция фиброзной ткани вокруг язвенного дефекта.
Изменения ЛДФ-грамм при стимуляции регенерации язвенного дефекта аллогенным трансплантатом становились достоверными к 3 суткам после введения препарата. Наиболее выраженными они были во второй зоне нарушений микроциркуляции. Средние значения показателя микроциркуляции составляли от 7,6 до 18,5 перфузионных единиц, отражая новообразование капилляров. При этом характер амплитудно-частотного спектра (АЧС) характеризовался спастико-атопической и застойной формами Фурье-преобразования, по-видимому, отражая пролиферацию капилляров и несовершенство путей оттока крови на фоне лимфостаза.
Отсутствие спонтанного заживления язвы в контрольной группе указывает на хронизацию патологического процесса. Это обусловлено воздействием на слизистую оболочку желудка повреждающих факторов и несовершенство репаративного процесса. Глубокие нарушения транскапиллярного обмена и микроциркуляции в зоне язвенного дефекта приводят к отсутствию заживления язв, либо к образованию грубых рубцов.
Достоверное уменьшение площади язвенного дефекта, возможность заживления язвы без образования грубого рубца, выраженные улучшения местной трофики позволили предложить данный метод как в комплексном консервативном лечении больных язвенной болезнью желудка и двенадцатиперстной кишки, так и для предоперационной подготовки.
В следующих сериях экспериментов у крыс резецировали желудок с восстановлением проходимости по второму способу Бильрот, с различными методами формирования желудочно-кишечных анастомозов. В первой группе экспериментальным животным выполняли резекцию желудка по Бильрот-2 с формированием гастроеюноанастомоза двухрядным узловым швом. Во второй группе применяли однорядный непрерывный шов. В третьей - линию однорядного шва укрепляли адгезивным перитонизирующим аллотрансплан-татом «Аллогем». В четвертой - использовали бесшовную методику формирования анастомоза с применением адгезивного перитонизирующего ал-лотрансплантата «Аллогем».
Анализ результатов данных компрессионного разрыва анастомоза показал, что в раннем послеоперационном периоде во все сроки после операции наименее надежен двухрядный шов, более надежен однорядный шов, наибольшую устойчивость к гидростатическому давлению имеет однорядный непрерывный шов, дополнительно перитонизированный аллогенным трансплантатом. При этом высоки не только исходные цифры давления разрыва, но и отсутствие выраженного падения гидравлической устойчивости анастомоза в период 1-7 суток. Восстановление максимальной устойчивости во всех экспериментальных группах происходило раньше, нежели в контрольной группе. Представляется важным, что минимальные значения гидравлической устойчивости анастомоза при использовании предложенных во второй и особенно третьей группе методов к моменту начала стадии фиброплазии (3 сутки), были выше максимальных цифр давления разрыва анастомоза в контрольной группе, полученных к 15 суткам, то есть в стадию созревания соединительной ткани.
Анализ микроциркуляции в первой группе указывает на практически полное прекращение микроциркуляции в зоне анастомоза в период первых суток. Амплитудно-частотный спектр соответствует стазической форме нарушений кровотока, характеризует расширение артериол и венул, прекращение кровотока в капиллярном звене. Очевидно, что критическая ишемия зоны анастомоза связана с лигатурным давлением на края раны, превышающим перфузионные возможности микроциркуляторных модулей.
Картина микроциркуляции желудка на расстоянии 1-2 см от анастомоза характеризовалась как застойная форма нарушений капиллярного кровотока. В отличие от желудка, в дистальном направлении, то есть в стенке кишки, был более выражен спазм артериол, имелись участки ишемии, анализ амплитудно-частотного спектра трактовался как спастическая форма нарушений микроциркуляции. Состояние микроциркуляции при формировании анастомозов однорядными швами имело кардинальные отличия, нежели в контрольной группе (двухрядный шов). Прежде всего, состояние микроциркуляции в области анастомоза не носило характера стаза. Показатель микроциркуляции в первые сутки в группе однорядного шва составил 75,3 ± 5,5 % от показателя микроциркуляции интактного желудка, взятого за исходный уровень. Наименьшее снижение (92,8 ± 7,5 % к исходному уровню) отмечалось в группе с бесшовной методикой формирования анастомоза. В эти сроки в областях желудка и тощей кишки, непосредственно прилежащих к анастомозу, было зарегистрировано достоверное увеличение показателей кровотока. Примечательно, что уже в период 1 суток при использовании однорядных методов формирования желудочно-кишечных анастомозов происходит рост частоты колебаний всех типов волн ЛДФ-граммы (рис.1.). Преобладает низкочастотный компонент, отражающий активность прекапиллярных сфинктеров. По сравнению с первой группой экспериментов, этот прирост составил 30,5 % в первые сутки и 42,8 % в третьи сутки. При этом интенсивность капиллярного кровотока в частях желудка и тонкой кишки, непосредственно прилежащих к зоне анастомоза, несколько ниже, нежели в контрольной группе.
По-видимому, при использовании однорядных и бесшовных методов формирования происходит перераспределение капиллярного кровотока в пользу зоны анастомоза, что служит основой для полноценной регенерации.
Анализ ЛДФ-грамм на третьи сутки, считающиеся критическими для развития такого грозного осложнения, как несостоятельность анастомоза, показал, что отсутствие механической компрессии зоны анастомоза лигатурами, при применении однорядного шва, сохраняет ритмические колебания кровотока - флаксмоции. Амплитуда ритмов (А) зависит от расстояния до анастомоза. При этом нормированные показатели А как по уровню ЛДФ-сигнала (А ритма/ПМх100%), так и по уровню флаксмоции (А ритма/ЗСКОх100%) характеризуются достаточно высокой устойчивостью при всех видах однорядных анастомозов.
Представленные данные свидетельствовали, что спонтанные колебания кровотока в области анастомоза и прилежащих отделах желудка и тощей кишки характеризуются соотношениями ритмических составляющих флаксмоции. По амплитуде среди флаксмоции преобладают вазомоции, характеризующие активный механизм перераспределения крови в системе микроциркуляции в условиях регенерации органов, имеющих разное гистологическое строение (желудок - тонкая кишка). Наиболее устойчивыми характеристиками являются нормированные показатели ритмических составляющих по уровню показателя микроциркуляции и среднеквадратичному отклонению. Это позволяет предположить, что нормированные показатели ритмических составляющих флаксмоции отражают наиболее важные гемодинамические характеристики микроциркуляции, связанные с внутрисосудистым тонусом, а также эффективность микроциркуляции в исследуемом участке ткани.
Таким образом, морфологические и функциональные исследования микроциркуляторного русла желудочно-кишечных анастомозов, сформированных в эксперименте различными способами, показали, что только однорядные и бесшовные методы формирования анастомозов обеспечивают сохранение эффективной микроциркуляции зоны анастомоза в критические для заживления сроки.
Клиническая часть
С целью изучения микроциркуляции при язвенной болезни желудка и двенадцатиперстной кишки была проведена работа по изучению микроциркуляции в норме.
Контрольная группа была сформирована из 25 практически здоровых людей - добровольцев, которым была выполнена фиброгастродуоденоско-пия. Результаты биохимических и морфологических исследований показали, что ни в одном случае в биоптатах исследуемых участков желудка и двенадцатиперстной кишки Helicobacter pylori обнаружены не были. Данные пациенты составили контрольную группу для оценки состояния микроциркуляции. Были проведены прицельные исследования капиллярного кровотока в различных отделах желудка и двенадцатиперстной кишки. Полученные данные указывают на достаточно высокие показатели микроциркуляции желудка и двенадцатиперстной кишки у здоровых лиц. Наименьшие показатели наблюдаются в кардиальном отделе и в области дна желудка. По мере приближения к пилорическому отделу интенсивность микроциркуляции увеличивается. Наши данные укладываются в полученные ранее схемы топографии микроциркуляции желудка и двенадцатиперстной кишки (Хасанов А.Г.,1997). По-видимому, усиление микроциркуляции по мере нарастания кислотности желудочного содержимого является защитно-приспособительной реакцией, направленной на подавление ульцерогенеза.
Для установления патогенетической связи между инфицированностью Helicobacter pylori и состоянием микроциркуляции проведены исследования у 145 пациентов, поступивших в клинику по поводу язвенной болезни. Желудочную локализацию язв имели 35 больных, у 100 больных язва находилась в двенадцатиперстной кишке. У всех больных в биоптатах слизистой оболочки различных зон желудка и двенадцатиперстной кишки были обнаружены Helicobacter pylori.
Однако степень инфицированности была различна. По данным полуколичественного экспресс-метода, больные были разделены на три группы. В первой группе положительная оценка теста появилась в период от 30 мин до 1 часа, что соответствовало НР+++ (91 пациент или 62,8 %). Во вторую группу больных вошли пациенты с положительной реакцией, проявившейся в те-чение 2-3 часов, что соответствовало уровню НР++ (37 пациентов или 25,5 %). У 17 больных (11,7 %) тест был положителен в срок до 24 часов, что было расценено как НР+.
Скорость и интенсивность проявления положительной реакции были прямо пропорциональны степени выраженности местных патоморфологических изменений при язвенной болезни.
Анализ капиллярного кровотока в данной группе больных показал его снижение, вплоть до критического уровня перфузии. Особенно низкие показатели микроциркуляции наблюдались у больных с высоким уровнем инфицированности Helicobacter pylori при язвенной болезни двенадцатиперстной кишки.
В среднем в группе больных с инфицированностью НР+++ падение уровня тканевой перфузии луковицы двенадцатиперстной кишки составило до 54,9 % от контрольного уровня, в области антрального отдела - до 60, 8 %, в области тела желудка - до 58,5 %. Достоверных изменений микроциркуляции кардиального отдела и дна желудка выявлено не было.
Таким образом, контаминация Helicobacter pylori, усугубляющая нарушения кровотока, играет важную роль в образовании язвенных дефектов и хронизации язвенного процесса.
Общепризнанно, что консервативная медикаментозная терапия может быть эффективной лишь в случаях высокой концентрации лекарственных препаратов в патологическом очаге. Применительно к рассматриваемой проблеме, определяющим фактором эффективности любого медикаментозного воздействия на язвенный дефект является его биологическая доступность, в прямой степени связанная с состоянием микроциркуляции.
Нами у 218 больных язвенной болезнью желудка и двенадцатиперстной кишки наряду с оценкой кровотока в вышеописанных гастродуоденаль-ных зонах, был исследован капиллярный кровоток в области язвенного дефекта. Датчик аппарата ЛАКК-01 вводили через биопсийный канал эндоскопа. Анализ кровотока показывает, что хроническая язва двенадцатиперстной кишки имеет в центре критически низкие значения микроциркуляции. Околоязвенная зона, наоборот, характеризуется повышенными значениями микроциркуляции. Однако анализ ЛДФ-грамм таких больных показывает, что воспалительная гиперемия, вызывающая рост показателя микроциркуляции, не приводит к нормализации сосудистого тонуса и не повышает эффективность микроциркуляции. Расшифровка амплитудно-частотного спектра указывает на застойную форму нарушений микроциркуляции.
Анализ показателей микроциркуляции показал, что снижение перфузии тканей в области язвенного дефекта сопровождается резким падением амплитуды и частоты флаксмоций. Вероятнее всего, это связано с массивными фиброзными разрастаниями в области язвы. Фиброз интерстиииального пространства, особенно при рецидивных язвах, изменяет характеристики микроциркуляции, затрудняя и без того нарушенную перфузию тканей кислородом, затрудняет транскапиллярный обмен, и создает условия для реализации факторов ульцерогенеза.
При исследовании капиллярного кровотока при язвенной болезни двенадцатиперстной кишки получены данные, указывающие на достоверное снижение капиллярного кровотока во всех отделах гастродуоденальной зоны, включая антральный отдел и тело желудка. Так, показатель микроциркуляции тела желудка с 25,4 ± 2,8 перфузионных единиц при язвенной болезни снизился до 18,1 ± 2,5 перфузионных единиц (66,1 % от исходного). Падение перфузии тканей в антральном отделе произошло с уровня 27,7 ± 3,3 перфузионных единиц до уровня 18,3 ± 2,6 перфузионных единиц, или на 34 %. В луковице двенадцатиперстной кишки показатель микроциркуляции снизился с 18,1 ± 1,9 перфузионных единиц до 10,9 ± 1,5 перфузионных единиц, падение микроциркуляции в луковице составило 40 % от исходного уровня.
Приведенные данные свидетельствуют, что при язвенной болезни желудка и двенадцатиперстной кишки страдает микроциркулядия всех отделов гастродуоденальной зоны. Однако, как наши данные, так и данные литературы (Henderson J.М., 1999), указывают на защитный характер изменений микроциркуляции в ответ на пептическую агрессию.
Характер нарушений микроциркуляции в области язвы, сопровождающийся критическим снижением ее перфузии, побудил нас к внедрению в клинику методов тканевой, интерстициальной терапии язвенной болезни желудка и двенадцатиперстной кишки. Контрольную группу составили 104 пациента с язвенной болезнью желудка и двенадцатиперстной кишки.
Комплексная медикаментозная терапия в лечении больных язвенной болезнью желудка и двенадцатиперстной кишки в контрольной группе проводилась стандартизованным образом. Рубцевание язв наступало на 21,5 ± 1,5 сутки.
В процессе заживления дно язвы приобретает неправильную форму, дно уплощается, постепенно очищается от некротических и фибринных наложений, края становятся менее отечными, уменьшается гиперемия слизистой оболочки вокруг язвы. При полном заживлении язвенного дефекта на месте язвы выявляется белесоватый или розоватый нежный рубец. Окружающая слизистая оболочка деформирована Рубцовыми тяжами, звездообразно направленными к центру бывшего язвенного дефекта. Если язва локализовалась в пилорическом отделе желудка или луковице двенадцатиперстной кишки, отмечается деформация просвета органа, более выраженная при рецидивных язвах.
Основную группу составили 133 больных, которым проводилось комплексное медикаментозное лечение с применением эндоскопических инъекций аллогенного соединительнотканного препарата Аллоплант. Отбор больных на эндоскопическое лечение проводился после обязательного гистологического исследования биопсийного материала. Инъекции проводили параллельно с общепринятой противоязвенной терапией с интервалом 3-4 дня. Кратность введения стимулятора регенерации зависела от язвенного дефекта - тенденции к его уменьшению, очищению дна язвы, снижению воспалительных явлений. На 2-3 сутки отмечалось усиление воспалительного процесса вокруг язвенного дефекта в виде гиперемии и отека слизистой оболочки. На 6-7 сутки отмечалась краевая эпителизация, уменьшение размеров язвенного дефекта и явлений воспаления, размягчение рубцовых изменений вокруг язвы и небольшое количество подслизистых кровоизлияний, уплощение дна язвы. На дне язвы был нежный белесоватый налет. На 9-12 сутки на месте язвенного дефекта определялась розовая слизистая с мелкими эрозиями и мелкими подслизистыми кровоизлияниями. На 15 сутки эндоскопически определялась розоватая слизистая оболочка. Морфологическая картина язвенного дефекта в основной и контрольной группах до начала лечения была идентичной.
На 2- 3 сутки происходили выраженные изменения микроциркуляции в области язвенного дефекта и околоязвенной области, связанные с изменением всех показателей ЛДФ-грамм. Так, изменения в основном касались непосредственно язвенного дефекта. Благоприятным прогностическим признаком, указывающим на восстановление эффективной микроциркуляции, было появление медленных волн. Необходимо отметить, что во всех наблюдениях микроциркуляторные изменения выявлялись раньше, нежели изменения гистологического строения области язвы.
При гистологическом исследовании биопсийного материала обнаружена следующая динамика патологического процесса.
Признаки хронического воспаления (наличие плазматических клеток, лимфоцитов, макрофагов в собственной пластинке) нарастали в течение первых пяти дней, главным образом за счет увеличения относительного количества макрофагов и лимфоцитов. К 15 дню данные проявления значительно снижались в сравнении с исходным уровнем. Кроме того, на 3 сутки отмечается появление фибробластов, в большей степени- в краях язвенного дефекта. Тканевые базофилы встречались в единичных количествах на 2 сутки, в последующие периоды данные клетки не обнаруживались. Активность процесса, определяемая, в основном, по наличию в инфильтрате нейтрофильных гранулоцитов, имела стойкую, выраженную тенденцию к снижению с первых суток от момента введения Аллопланта. Признаки атрофии слизистой оболочки (в данном случае учитывались высота и форма ворсин, количество крипт в поле зрения) усиливались на 2 сутки, но с 3-4-го и до 15 дня наблюдалось практически полное восстановление слизистой оболочки с нормализацией всех ее составляющих структур. Указанные процессы имели более выраженное проявление и динамику в крае язвенного дефекта, и в меньшей степени - в собственной пластинке вокруг язвы.
В изучаемых участках слизистой оболочки базальная мембрана эпителия во всех периодах имела относительно одинаковую структуру, и характеризовалась преимущественно фрагментарным разволокнением. Кроме этого, отмечается волнообразное накопление сульфатированных тликозаминогли-канов в эпителии и собственной пластинке двенадцатиперстной кишки. Коллагеноэластический каркас собственной пластинки слизистой оболочки в наблюдаемый период характеризовался сетчатой, гомогенной структурой.
К 9-12 дню от момента введения Аллопланта язвенный дефект покрывался эпителиальной выстилкой, а к 15 дню гистологически наблюдалась полностью сформированная слизистая оболочка. Причем выраженность вышеописанных критериев патологического процесса в новообразованной слизистой оболочке в большинстве случаев была ниже в сравнении со слизистой оболочкой перифокальной зоны.
Наиболее важным представляется исследование микроциркуляции в ранние сроки после резекции желудка, до полного заживления анастомоза и формирования рубца, поскольку нарушения местной гемодинамики лежат в основе развития ранних, самых грозных осложнений резекции желудка.
Нами изучен капиллярный кровоток в зоне анастомоза и культе желудка в различные сроки у больных, перенесших резекцию желудка по первому - 52 и второму - 54 способам Бильрот.
Контрольную группу составили больные, которым резекция желудка была выполнена с использованием двухрядного шва - непрерывный кетгутовый Шмидена + узловые серо-серозные швы Ламбера (175 больных) либо двухрядного внутриузлового шва Пирогова - Матешука - 230 больных.
У всех обследованных в раннем послеоперационном периоде отмечалось снижение показателей микроциркуляции, по сравнению с данными до операции. Так, значения показателя микроциркуляции в теле желудка снизились на 15,8 %, (р<0,05), значение эффективности микроциркуляции падало на 23,7 % (р<0,05). При анализе эндоскопической картины в данной группе больных было отмечено, что наиболее низкие значения микроциркуляции наблюдались у больных с рефлюксом дуоденального и тонкокишечного содержимого и явлениями пострезекционного рефлюкс-гастрита. Полученные нами данные изменений кровотока резецированного желудка на микроцир-куляторном уровне согласуются с данными об изменениях органной гемодинамики, полученными ранее методами реоплетизмографии (Тимербулатов В.М., Хасанов А.Г., 1997).
При исследовании микроциркуляции в области анастомоза более высокие показатели были отмечены у больных с удовлетворительной эндоскопической картиной. Застойные и стазические изменения микроциркуляции наблюдались при сужениях анастомозов и анастомозитах. Наиболее низкие показатели маргинальной зоны анастомоза наблюдались при атрофических изменениях, сглаженной истонченной слизистой оболочке.
Эндоскопическая картина анастомозов, сформированных двухрядным швом, показала, что, начиная с первых суток послеоперационного периода в области анастомоза развивается острый воспалительный процесс, проявляющийся выраженной диффузной гиперемией, отеком, инфильтрацией с образованием тканевого валика толщиной до 5 - 7 мм. Анастомоз в виде складки, с трудом раскрывающийся при инсуффляции воздуха. Участки краевого некроза занимают весь периметр анастомоза. При гистологическом исследовании - густая лейкоцитарная инфильтрация: нейтрофилы в состоянии дегенерации, некоторые- с признаками деструкции, имеется выраженный отек и полнокровие капилляров. Выявляются очаги некробиоза клеток, белковый и гнойный экссудат. Острый воспалительный процесс наблюдается в течение 7 - 10 суток, причем на 2-3 сутки нередко отмечается увеличение площади имеющихся дефектов слизистой оболочки, нарастание отека, имеющейся воспалительной инфильтрации. Морфологическая картина прежняя.
Процессы регенерации начинаются с 11 - 12 суток, после отторжения некротических тканей и отхождения экссудата, по линии стыка с области анастомоза определяются малиновые или красные мелкозернистые грануляции с выраженной кровоточивостью. В сроки от 7 до 18 суток отмечалось отторжение кетгутовой или капроновой нити, при этом в участках отторжения отмечается усиление воспалительных явлений - «выгнаивание» лигатуры, увеличивается количество серозно-гнойного экссудата. Эпителизация зоны анастомоза наблюдается через 3-4 недели. В это же время появляется сократительная деятельность в области анастомоза, но полное восстановление функциональной способности требует гораздо большего времени, часто до 2-х месяцев, после отторжения второго ряда швов.
Отмечается падение показателей микроциркуляции в период 1 - 3 суток после операции Бильрот-1, с некоторым восстановлением к 5 суткам. В целом, необходимо отмстить, что состояние микроциркуляции гастродуоде-ноанастомоза претерпевает меньшие изменения при этом способе операции, нежели при способе Бильрот-2.
Анализ микроциркуляции анастомозов, сформированных после резекции желудка, показал, что ведущим фактором, достоверно влияющим на состояние микроциркуляторного русла, является способ формирования анастомозов. При этом их основные параметры отличались в 2-3 раза.
Полученные данные показывают, что необходимым условием неосложненного течения послеоперационного периода является восстановление микроциркуляции зоны анастомоза к 3 суткам. Если этого в силу ряда причин не происходит, вероятность несостоятельности швов, как показали дальнейшие исследования, многократно увеличивается. Таким образом, анализ данных микроциркуляции в раннем послеоперационном периоде показывает, что резекция желудка по первому способу Бильрот сопровождается меньшими нарушениями микроциркуляции, причем наличие критического падения показателя микроциркуляции в области гастроеюноанастомоза предполагает разработку методов оперативных вмешательств с максимальным сохранением микроциркуляции.
Спустя 3-4 месяца после операции, при отсутствии послеоперационных осложнений, происходит восстановление показателей микроциркуляции в разных отделах желудка. При этом параметры микроциркуляции резецированного по Бильрот-1 желудка не имеют достоверных отличий от показателей микроциркуляции в группе практически здоровых испытуемых. Между тем, в группе больных, оперированных по способу Бильрот-2, наблюдается снижение основных микроциркуляторных показателей в области тела желудка, по сравнению с контрольными и исходными значениями. По видимому, классическая резекция большого объема - 2/3 и 3/4 желудка, уносящая кислотопродуцирующую зону, приводит к исчезновению такого мощного фактора регуляции, как значение РН. Следовательно, при снижении кислотности и уменьшении перфузии кровью слизистой оболочки, последняя становится более подверженной действию таких факторов, как желчные кислоты, пищеварительные ферменты и др. Это приводит к развитию как анастомозита, так и рефлюкс-гастрита. Повышение показателей микроциркуляции в области анастомоза в отдаленные сроки вероятно связано с реализацией компенсаторно-приспособительных механизмов. Увеличение как амплитуды, так и частоты флаксмоций, с другой стороны, отражает гемодинамические изменения, неизбежно возникающие при формировании соустья между такими различными по морфологическим и функциональным характеристикам органами, как желудок и тонкая кишка.
Больные, которым при резекции желудка были сформированы анастомозы однорядным швом, были разделены на 2 группы. В первой группе больных - 155 случаев, был сформирован однорядный гастроэнтероанастомоз непрерывным швом рассасывающейся синтетической нитью. Во второй группе (85 больных) дополнительно линия анастомоза была укрыта аллотрансплантатом «Аллогем», изготовленным из аллогенной париетальной брюшины и обработанным компонентами фибринового клея.
С целью изучения динамики заживления анастомозов, сформированных различными методиками, всем больным выполнялась эзофагогастроин-тестиноскопия. Морфологическому анализу подвергнуты биоптаты слизистой оболочки области анастомоза двух групп больных по 50 человек, с неосложненным течением послеоперационного периода.
При использовании методик однорядного непрерывного шва с перитонизацией линии швов аллотрансплантатом «Аллогем», обработанным компонентами фибринового клея, воспалительные явления часто носили минимальный характер. Отмечалось развитие катаральных форм воспаления в области соустья с единичными эрозиями. Более или менее значимой инфильтрации, экссудации, увеличения плошали дефекта слизистой оболочки не наблюдалось. Эпителизация дефекта наступала на 5 - 7 сутки. Края слизистых оболочек ровные, хорошо адаптированы, места их стыка трудноразличимы. При гистологическом исследовании биоптатов обращает на себя быстрая (к 10 - 14 суткам) полноценная эпителизация места стыка. Характерна картина хронического воспаления: малоклеточная, в основном лимфоплазматическая инфильтрация, невыраженный отек, исчезающий к 3 суткам. Такую минимальную тканевую реакцию мы связываем с восстановлением биологической герметичности анастомоза и компенсацией повышения гидростатического давления в культе желудка. С другой стороны, использование рассасывающего синтетического материала, биологически инертного, также уменьшает степень воспалительной реакции. Мы использовали нити «Даксон», «Максон» и «Полисорб». При эндоскопическом контроле в отдаленные сроки после операции явления поверхностного анастомозита никакой оценке не подвергались, так как во всех случаях зависели от типа произведенной операции, а в случаях наиболее частой модификации типа Гофмейстера-Финстерера выявленные изменения мало отличались в период 6, 12 и 24 месяцев при всех использованных методиках.
Анализ показателей микроциркуляции показывает, что при использовании однорядного шва не происходит критического падения основных показателей перфузии кровью. Восстановление показателя микроциркуляции происходит к 3 суткам, сосудистого тонуса - к 5 суткам, эффективность микроциркуляции в первые сутки составила 73,6 ± 6,9 %, во вторые и третьи -81,5 ±7,5 % и 92,8 ± 10,5 % соответственно. Таким образом, для обычной резекции желудка, протекающей без технических трудностей, наложение второго ряда швов при формировании гастродуоденоанастомоза и гастроеюноа-мастомоза необоснованно, в отличие от правильно наложенного однорядного анастомоза.
Другим путем коррекции микроциркуляции для обеспечения полноценной регенерации анастомоза является использование клеевых методик. Проблема формирования бесшовного анастомоза при резекции желудка была решена в эксперименте в работах В.С.Гигаури (1985 - 1991). Однако в широкую клиническую практику использование фибринового клея для формирования гастроеюноанастомоза не вошло.
Несомненно, что наиболее частой причиной развития ранних пострезекционных осложнений являются технические трудности, возникающие при низких, пенетрируюший язвах, спаечном процессе, рубцовых деформациях, свищах и т.д. В ряде ситуаций хирург сталкивается с проблемой плохо ушитой культи двенадцатиперстной кишки, либо он не уверен в надежности швов желудочно-кишечного анастомоза. В ситуациях, когда сформирован анастомоз непрерывным однорядным швом рассасывающейся монофиламентной нитью, и хирург не уверен в его биологической герметичности, наложение второго ряда швов сводит на нет все преимущества однорядного шва. Для этих ситуаций нами был предложен способ защиты линии швов, который совместил в себе преимущества однорядного шва с приданием анастомозу биологической герметичности и увеличением механической прочности с помощью аллотрансплантата «Аллогем» (А.С. 3.4925430/14/28968). Аллотрансплантат «Аллогем» в данной ситуации аналогичен известному препарату фирмы Никомед «Тахокомб». При этом используемый нами препарат при сходных свойствах адгезивности, обладает следующими особенностями:
- в отличие от «Тахокомба», основой пластины которого является лошадиный коллаген, «Аллогем» изготавливается из аллогенной брюшины, то есть линия анастомоза укрывается сходной по эластическо-коллагеновому строению тканью;
- «Аллогем», в отличие от подавляющего большинства бессосудистых трансплантатов, тотчас после приклеивания включается в процессы транскапиллярного обмена с тканевым ложем, что обеспечивает его приживление;
- полная резорбция «Аллогема» происходит в течение трех месяцев после применения, при этом трансплантат замещается сходной по строению тканью организма.
Возможно применение данного препарата как циркулярно, по всему периметру анастомоза, так и фрагментарно, для перитонизации технических дефектов. При этом анастомоз приобретал, как показали проведенные выше экспериментальные исследования, биологическую герметичность. С другой стороны, применение данного метода позволило увеличить механическую прочность анастомоза.
За исследуемый период с сентября 1995 года по сентябрь 2000 года были выявлены следующие осложнения со стороны гастроэнтероанастомоза:
- несостоятельность анастомоза - 20 случаев (12 - при использовании двухрядного шва со швом Шмидена (4,3 %), 8 - при использовании шва Пирогова-Матешука (1,75 %), не было - при использовании однорядного непрерывного шва;
- кровотечение - 24 случая, в том числе (18 (5,7 %)- при использовании двухрядного шва со швом Шмидена, 8 (1,75 %) - при использовании шва Пирогова-Матешука, не было осложнения - при использовании однорядного непрерывного шва;
- анастомозит - 40 больных, из них двухрядный шов со швом Шмидена был применен у 24 пациентов (8,8 %), у 12 - шов Пирогова-Матешука, у 4 (1,3 %)- однорядный непрерывный шов.
Несостоятельность анастомоза выявлена у четырех больных с язвенной болезнью желудка, оперированных на высоте кровотечения и у 16 больных с язвенной болезнью двенадцатиперстной кишки. После плановых операций возникло 10 таких осложнений.
В 8 случаях кровотечения из зоны анастомоза потребовалась релапаротомия в связи с безуспешной консервативной терапией. Во всех случаях был использован двухрядный шов.
При математической обработке данных было получено, что различия между показателями осложнений в группах однорядного шва и шва Пирогова-Матешука статистически недостоверны, хотя процент осложнений ниже в несколько раз. При сравнении с группой двухрядного шва со швом Шмидена различия достоверны (р<0,05) .Общее количество случаев осложненного течения раннего послеоперационного периода в первой и второй группе с использованием методик двухрядного шва составило 80 наблюдений (10,8 %), в основной группе - было выявлено 4 случая анастомозита, что не потребовало проведения релапаротомий.
В послеоперационном периоде умерло 36 больных (4,27 %). У 9 умерших (1,06 %) имела место несостоятельность гастроэнтероанастомоза, у 3 (0,36 %) - кровотечение из области гастроэнтероанастомоза и у 1 умершего (0,12 %) был тяжелотекущий анастомозит 3 степени. У 23 умерших (2,73 %) была несостоятельность культи двенадцатиперстной кишки. У всех умерших основное заболевание имело осложненное течение. Все умершие страдали сопутствующими заболеваниями разной степени выраженности. Кроме вышеперечисленных осложнений, причинами смерти больных были острое нарушение мозгового кровообращения, острая сердечно-легочная недостаточность на фоке тромбоэмболии легочной артерией инфаркта миокарда, панкреонекроз, хроническая и острая почечная недостаточность и др.
Смертность в группе классического двухрядного шва составила 6,4 % от общего уровня летальности, в группе шва Пирогова-Матешука - 5,1%, в группе однорядного непрерывного перитонизированного шва - 2,6 %.
Таким образом, анализ результатов резекций желудка в Республиканской клинической больнице им Г.Г. Куватова за 5-летний срок показывает, что больше всего осложнений со стороны анастомоза в раннем послеоперационном периоде было в группе больных, которым выполнен двухрядный шов Шмидена. Значительно меньший процент осложнений наблюдался при использовании швов Пирогова-Матешука и еще меньший - при использовании перитонизированного однорядного непрерывного шва с применением, аллотрансплантата «Аллогем». При этом не было таких тяжелых осложнений, как несостоятельность и кровотечения при использовании этой методики.
Таким образом, наши экспериментальные и клинические данные свидетельствуют о необходимости включения методов лазерной допплеровской флоуметрии в арсенал диагностических средств при обследовании больных с язвенной болезнью и эффективности применения аллотрансплантатов серии Аллоплант и «Аллогем» для хирургического и консервативного лечения язвенной болезни желудка и двенадцатиперстной кишки.
Заключение и практические рекомендации
При язвенной болезни желудка и двенадцатиперстной кишки происходят глубокие нарушения микроциркуляции всех отделов желудка и двенадцатиперстной кишки. В интактиых отделах желудка уровень микроциркуляции компенсаторно повышен, его значения зависят от уровня РН.
Нарушения микроциркуляции приводят к увеличению степени инфицированности Helicobacter pylori, снижение показателя микроциркуляции ниже 12,6+1,5 перфузионных единиц сопровождается 95,8 % уровнем контаминации Helicobacter pylori слизистой оболочки желудка и двенадцатиперстной кишки.
В области язвенного дефекта наблюдаются критически низкие значения микроциркуляции, в околоязвенной области капиллярный кровоток несколько повышен, однако наблюдаются явления дисфункциональной ди-лятации всех звеньев микроциркуляторного русла.
Расстройства микроциркуляции в области язвы приводят к нарушениям процессов репарации. Это требует введения в схему консервативного лечения и предоперационной подготовки препаратов интерстициальной терапии, способных стимулировать регенерацию и улучшать микроциркуляцию непосредственно в патологическом очаге.
Эндоскопическое интерстициалыюе введение дисперсного аллогенного трансплантата - стимулятора регенерации Аллоплант в комплексной медикаментозной терапии язвенной болезни и в процессе предоперационной подготовки активизирует транскапиллярный обмен и микроциркуляцию в области язвенного дефекта, что позволяет восстановить структуру пораженной Области с развитием грануляционной ткани и трансформацией ее либо в нежный рубец, либо достичь Эпителизации язвенного дефекта без образования рубца.
Резекция желудка сопровождается значительными расстройствами мик-роциркуляции в области культи желудка и анастомоза, причем при использовании двухрядных швов в первые 3 суток параметры микроциркуляции имеют предельно малые значения, отражая критически низкий уровень перфузии тканей кровью.
Применение однорядного непрерывного шва синтетическим рассасывающимся материалом при формировании гастроэнтероанастомоза позволяет избежать микроциркуляторных расстройств, перитонизация же его пленчатым аллотрансплаптатом «Аллогем» с элементами фибринового клея увеличивает механическую прочность анастомоза, придает ему биологическую герметичность, и результате предотвращая развитие ранних послеоперационных осложнений.
Применение предложенных методов стимуляции регенерации и коррекции микроциркуляции позволили улучшить результаты консервативного и хирургического лечения больных с язвенной болезнью желудка и двенадцатиперстной кишки за счет снижения ранних послеоперационных осложнений с 10,8 % до 1,3 % и легальности с 6,4 % до 2,6 %.
Практические рекомендации
Лазерная допплеровская флоуметрия с использованием отечественного анализатора капиллярного кровотока ЛАКК-01 является доступным неинвазивным методом контроля за состоянием микроциркуляции гастродуо-денальной зоны. Показатели микроциркуляции отражают характер регенераторного процесса и являются критериями эффективности консервативной терапии и состояния гастроэнтероанастомозов при оперативном лечении язвенной болезни желудка и двенадцатиперстной кишки.
При лечении хронических язв желудка и двенадцатиперстной кишки, особенно носящих каллезный характер, с грубыми деформациями стенки кишки, необходимо включить в схему консервативной терапии и предоперационной подготовки интерстициальные инъекции аллогенного стимулятора регенерации Аллоплант.
Гастроэнтероанастомоз;при резекции желудка по второму способу Бильрот должен быть сформирован однорядным непрерывным рассасывающимся швом современным синтетическим материалом («Максон», «Даксон», «Полисорб» и др).
Для улучшения механических свойств однорядного анастомоза, придания ему биологической герметичности линию швов необходимо перитонизи-ровать пленчатым аллотрансплантатом с элементами фибринового клея «Аллогем».
Литература
1. Функциональное состояние эндокринных органов в ближайшем послеоперационном периоде // Советская медицина, 1991, №12, с.18-19. Соавторы: В.М. Буянов, А.Р. Янгиев, Р.М. Таджимуратов.
2. Значение пилорических геликобактеров в хирургическом лечении больных язвенной болезнью желудка и двенадцатиперстной кишки // Советская медицина, 1991, №7, с.7-11. Соавтор: В.М.Буянов.
3. Значение геликобактеров в выборе оптимального хирургического лечения язвенной болезни // Советская медицина, 1992, №5, с.13-14. Соавторы: В.М. Буянов, А.Р. Янгиев.
4. Значение пилорических геликобактеров и иммуноглобулинов в хирургическом лечении язвенной болезни // Сб. трудов общества хирургов г. Москвы и Московской области, 1992, с. 7-8. Соавтор: В.М. Буянов.
5. Совершенствование резекционных методов лечения язвенной болезни желудка и двенадцатиперстной кишки // Методические рекомендации - Уфа, 1995, 25 с. Соавтор: В.М. Тимербулатов.
6. Лазерная допплеровская флоуметрия в оценке микроциркуляции оперированного желудка // Материалы Ш междунар. конф. «Актуальные вопросы лазерной медицины и операционной эндоскопии».- М, 1994, с.85-86. Соавтор: В.М. Тимербулатов.
7. Способ бесшовного гастроэнтероанастомоза в эксперименте // «Вопросы теоретической и клинической медицины» Матер, научно-практ.конф., Уфа, 1995, с.25-26. Соавторы: Р.С. Мингазов, А.Х.Мустафин.
8. Микроциркуляторное русло желудка при моделировании язвенного дефекта в эксперименте //«Вопросы теоретической и клинической медицины» Матер, научно-практ.конф., Уфа, 1995, с.26- 27. Соавторы: Р.С. Мин-газов, А.Х.Мустафин.
9. Сравнительный анализ микроциркуляторных изменений при формировании различных видов анастомозов // «Вопросы теоретической и клинической медицины» Матер, научно-практ.конф., Уфа, 1995, с.27- 28. Соавторы: Р.С. Мингазов, А.Х.Мустафин.
10. Влияние геликобактериоза на хирургическое лечение язвенной болезни // Тез. Всероссийской конференции хирургов «Новые технологии в хирургии», Уфа, 1994, с.77. Соавтор: В.М. Тимербулатов.
11 .Новые возможности применения лазеров в хирургии язвенной болезни желудка и двенадцатиперстной кишки // «Актуальные вопросы лазерной медицины и операционной эндоскопии», Матер Ш междунар. конф, М, 1994, с.99-100. Соавторы: М.А.Нартайлаков, А.Х.Мустафин, И.А.Сафин, С.Х.Бакиров, В.П.Соколов.
12.Морфо-функциональная оценка эффективности применения гелий-неонового лазера при пострезекционных анастомозитах // «Актуальные вопросы клиники внутренних болезней» Матер. Респ. Научно-практ конф, Уфа,1996, с.67 - 68. Соавторы: М.А.Нартайлаков, И.А.Сафин.
13. Применение лазерной допплеровской флоуметрии для диагностики микроциркуляторных нарушений при язвенной болезни // Здравоохранение Башкортостана, 1999, №2, с. 128. Соавторы: М.А. Нартайлаков, Ш.А.Зарипов.
14. Профилактика гипертрофических и келлоидных рубцов // Юбилейный сборник научных трудов хирургов Республики Башкортостан, Уфа, 1995, с. 57. Соавторы: И.А. Сафин, В.П. Соколов, Х.З. Абдрашитов, ВС Пантелеев.
15. Минилапаротомная лазерная резекция желудка с применением однорядного кишечного шва // Юбилейный сборник научных трудов хирургов Республики Башкортостан, Уфа, 1995, с. 38. Соавторы: Х.З. Абдрашитов, М.А Нартайлаков, В.П. Соколов.
16. Показатели микроциркуляторного русла желудка при различных видах наложения шва // Юбилейный сборник научных трудов хирургов Республики Башкортостан, Уфа, 1995, с. 64. М.А. Соавторы: Нартайлаков, И.А. Сафин, И.М. Аминев.
17. Ошибки по ургентной хирургии язвенной болезни желудка и двенадцатиперстной кишки по материалам САС // «Актуальные вопросы управления, организации здравоохранения и клинической медицины» Уфа, 1997, с.53-55. Соавторы: М.А.Нартайлаков, Н.В.Пешков, Ш.Н.Муслимов.
18. Новое в хирургическом лечении осложнений язвенной болезни желудка и двенадцатиперстной кишки // Юбилейный сборник кафедры оперативной хирургии и клинической анатомии. 1999, с. 32 - 33. Соавторы: А.Х. Мустафин, М.А. Нартайлаков, И.А. Сафин, Р.С. Мингазов.
19.Влияние объема эритроцитов и тромбоцитов на показатели внешнего дыхания хирургических больных // «Итоги научных исследований биологического факультета БГУ за 1996 г.», Уфа, 1997, с. 103 - 104. Соавторы: В.Н.Павлов, М.Г.Ядыкина, Р.М.Баширова, Н.А.Киреева, Е.М.Гареев.
20.The application of leser in the surgical treatment of duodenal ulcer // The 1-st. International Congress. Limassol, Сурrоs, 1997, р. 160: Socolov V.P.,Nartailacov M.A., Abdrashitov H.Z. 21.Минилапаротбмная лазерная резекция желудка по Бильрот-1 с компрессионным латеро-латеральным анастомозом // Международный конгресс. Лазер и здоровье. Москва, 1999, с.7. Соавторы: Х.З. Абдрашитов, М.А. Нартайлаков, В.П. Соколов.
22.Показатели микроциркуляторного русла желудка при различных видах кишечного шва // Международный конгресс. Лазер и здоровье. Москва,1999, с.36 Соавторы: В.И. Козлов, М.А. Нартайлаков.
23.Диагностика микроциркуляторных нарушений при язвенной болезни двенадцатиперстной кишки // Актуальные вопросы диагностики и лечения заболеваний органов гепатобилиарной зоны. Сб. тр. Республиканской конференции, посвященной 65-летию кафедры общей хирургии. Уфа, 2000, с.210.
24. Способ прогнозирования рецидива язвы и постваготомических осложнений // Изобретение 3.4941456/14/46389/ от 03.06.91 дело №485. Соавторы: В.М. Буянов, А.Р. Янгиев.
25. Способ выбора оперативного вмешательства при язве желудка и двенадцатиперстной кишки // Изобретение 3.4925430/14/28968/ от 04.04.91 г. дело №478. Соавторы: В.М. Буянов А.Р. Янгиев.
26. Устройство для витальной биомикроскопии микроциркуляции брыжейки крысы. Рац.предл. БГМУ № 1963 от 15.11.95 г. Соавторы: М.А. Нартайлаков, В.Н. Павлов, А.Х. Мустафин.
27. Способ регионарной антибактериальной терапии при перфоративной язве желудка. Рац. предл. БГМУ № 1916 от 24.04.98 г. Соавторы: М.А. Нартайлаков, Р.М. Валеев, Р.Р. Абдеев.
28. Способ получения аллогенного препарата с гемостатическими свойствами. Рац. предл. БГМУ № 1963 от 2.10.98 г. Соавторы: М.А. Нартайлаков, А.Х. Мустафин, Р.С. Мингазов.
29. Способ профилактики анастомозита после резекции желудка. Рац. предл. БГМУ № 1916 от 2.10.99 г. Соавторы: ИА. Сафин, В.П. Соколов, ВС. Пантелеев, СВ. Федоров.
30. Способ оценки эффективности лечения больных с язвенной болезнью желудка и двенадцатиперстной кишки. Рац. предл. БГМУ № 2180 от 17.02.2000 г. Соавторы: Х.З. Абдрашитов, А.Х. Мустафин, Ш.Н. Муслимов.
к содержанию | опубликовать статью
ЭКСПЕРИМЕНТАЛЬНО-МОРФОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ ДИСПЕРГИРОВАННОГО БИОМАТЕРИАЛА В КОМПЛЕКСНОМ ЛЕЧЕНИИ ХИМИЧЕСКИХ ОЖОГОВ ЖЕЛУДКА
Мухаметова З. Р.
ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию», г. Уфа ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
В работе показано, что эндоскопическое введение диспергированного биоматериала «Стимулятор регенерации» (ТУ42-2-537-2006) в подслизистый слой желудка активизирует комплекс сосудистых, клеточных и биомеханических реакций. При этом оптимизируются репаративные процессы в зоне химического поражения тканей, как в эксперименте, так и в клинической практике.
Актуальность
Токсические поражения желудка, и в том числе его химические ожоги, составляют от 18,8 до 38% случаев от всех ожоговых поражений верхнего отдела желудочно-кишечного тракта (Волков С.В. и др., 2005).
В последние годы данная патология переросла из актуальной медицинской задачи в важную социальную проблему (Лужников Е.А., Костомарова Л.Г., 2000). Подобная ургентная патология наибольшее распространение получила среди лиц трудоспособного возраста (Бикбаева А.И., Валиев Ф.Г., 1985).
Хирургическими осложнениями данной патологии являются ранние (6,3 -100% случаев) и поздние (1-5%) желудочные кровотечения (Синев Ю.В. и др., 1986), формирование рубцовых деформаций и стриктур (Марденов А.Б., 2002; Королев М.П., 2009). По данным ряда авторов, химические ожоги желудка первой и второй степени заживают с формированием перепончатых стенозов и локальных рубцов (Тамулевичуте Д.И., Витенас А.М., 1986). Следует признать, что консервативная терапия не всегда позволяет в должной мере достичь полноценного репаративного эффекта и предупредить развитие рубцовых осложнений (Абакумов М.М., 1988; Королев М.П., 2009).
В последние годы различные эндоскопические манипуляции, в том числе, применение биологических материалов, прочно вошли в клиническую практику (Перепелицын В.П., 2002;Чернеховская Н.Е. и др., 2007).
Ранее проведенные клинические исследования показали стимулирующее влияние диспергированных форм биоматериалов на процессы репаративной регенерации слизистой оболочки желудка при различных видах патологии: язвенной болезни желудка (Нартайлаков М.А., Зарипов Ш.А., 1998; Муслимов С.А., 2000), атрофическом гастрите (Арефьев К.А., 2002).
Для успешной реализации технологии эндоскопического введения различных препаратов, и в том числе биоматериалов, требуются дополнительные топографо-анатомические, биомеханические и экспериментально-морфологические исследования (Каган И.И., 2002, 2009). Прежде всего, необходимо изучение локальных особенностей фиброархитектоники подслизистого слоя различных отделов желудка, на уровне которого выполняются эндоскопические инъекции. Подобные исследования могли бы составить анатомическую основу для определения возможных путей распространения инъекционных форм биоматериалов. Кроме того, известно, что интегративным показателем морфофункционального состояния волокнистого остова является значение тканевого напряжения (Макаров А.К. и др., 1987). При этом в работах целого ряда авторов показано, что тензометрические методы являются объективным критерием в оценке динамики патоморфологических процессов (Лебединский Ю.В. и др., 2000). Планируя данную работу, мы также учитывали, что до настоящего времени отсутствуют экспериментально-морфологические исследования, репаративной регенерации при локальном введении биоматериалов на фоне моделирования ургентной патологии желудка.
Цель работы - экспериментально-морфологически обосновать эффективность эндоскопического введения инъекционной формы аллогенного биоматериала «Стимулятор регенерации» в схеме комплексного лечения химических ожогов желудка.
Материалы и методы исследования
Для достижения поставленной цели выполнены топографо-анатомические, экспериментально-морфологические и тензометрические исследования. В анатомическом разделе работы использованы органокомплексы пищевода и желудка от 11 трупов людей обоего пола второго периода зрелого возраста. На указанных органах выполнено макромикроскопическое препарирование с окрашиванием по А.П.Сорокину (1973) под микроскопом МБС-1. Одновременно забирались кусочки тканей для гистотопографических исследований в кардиальном отделе желудка, по малой и большой кривизне, передней и задней стенки тела, пилорической части, срезы окрашивались по Ван-Гизону, по Маллори, фукселином по Вейгерту, гематоксилином и эозином. Полученные препараты исследовались методом поляризационной микрофотографии. Для морфометрии использовалась программа Biovision.
Раздел анатомо-биомеханических исследований выполнен на шести кроликах породы Шиншилла. Через лапаротомный доступ взвесь биоматериала вводилась в подслизистый и мышечный слои в количестве 0,5 мл препарата в различных отделах желудка. Через 30 минут после инъекции животные выводились из опыта. Область введения биоматериала иссекалась для гистотопографических исследований.
Экспериментально-морфологическая часть исследования проводились на половозрелых крысах породы «Вистар». Экспериментальный ожог желудка моделировался раствором 30 % уксусной кислоты, вводимый через зонд в количестве 1,5 мл (по Лопухину Ю.М., 1971 с рекомендациями Заводской Ю.С., 1954). Затем в опытной группе стенку желудка, через лапаротомный разрез, обкалывали стимулятором регенерации, а в контрольной группе поражённая область оставлялась интактной (Рис.1.). Биоматериал «Стимулятор регенерации» в количестве 50 мг разводился в 10 мл физиологического раствора и вводился в область дефекта в две точки по 0,2-0,4 мл в подслизистую основу до образования практически на всем протяжении желудка инфильтративного депо. Аллогенный биоматериал готовился в тканевом банке Центра в соответствии с требованиями ТУ 42-2-537-2006 (диспергированный биоматериал – «Стимулятор регенерации»).
Динамику структурных изменений изучали через один час после химического ожога на седьмые сутки, 30-е сутки эксперимента, также производился забор желудка в норме. На гистологических препаратах измерялась высота фундальных желёз; в собственной пластинке определяли ряд показателей: клеточный состав (макрофаги и фибробласты), толщина волокон коллагена, суммарная площадь просвета капилляров (СППК) на единицу площади (27,8 тыс. мкм2).
Для введения диспергированного биоматериала в стенку желудка производилась лапаротомия под эфирным наркозом.
Рис.1. Экспериментальная модель химического ожога желудка и последующего введения инъекции диспергированного биоматериала «Стимулятор регенерации». А – контрольная серия: 1- зонд для введения уксусной кислоты диаметром 3 мм и 12 см в длину, 2- желудок крысы; Б – опытная серия: 1- пищевод крысы, 2- локальное введение стимулятора регенерации в стенку желудка с помощью иглы № 0840, 3- повторное обкалывание в нескольких точках, 4- желудок крысы.
Таблица 1.Эксперимент по ожогу желудка. Сроки забора экспериментального материала
| Серии опытов | Забор нормального желудка | Забор желудка сразу после ожога | Контрольная серия | Опытная серия | ||
| 7-е сутки | 30-е сутки | 7-е сутки | 30-е сутки | |||
| Количество животных | 5 |
5 |
5 |
5 |
5 |
5 |
Клиническая часть исследований выполнена на 26 пациентах с явлениями химического ожога желудка легкой и средней степени тяжести. Все исследованные пациенты находились на стационарном лечении в хирургическом отделении НУЗ «Отделенческая больница на ст. Уфа» ОАО «РЖД» с 2001 по 2006 г.г. Нами были рассмотрены случаи первой и второй степеней ожога желудка, и чаще являлись следствием употребления суррогатов алкоголя. У 13(50,0%) пациентов из всех обследованных отравление раствором уксусной кислоты, у 3(11,5%) пациентов случайное отравление электролитом, у 10(38,5%)- вещества неизвестного происхождения.
Эндоскопическое исследование осуществляли эндоскопами “Olympus” (Япония) GIF-XQ40, «Pentax 24V». Эндоскопический инструментарий фирмы «Olympus» (Япония). Забор материала для гистологического исследования проводили биопсийными щипцами.
По видам лечебной тактики больные с ожогами желудка разделены на две группы:
в 1-й группе (12 пациентов) проведено консервативное лечение. В схему комплексного лечения назначали инфузионную терапию, антибиотики, гормонотерапию. Курс лечения составлял 21 день.
во 2-й группе (14 пациентов) наряду с консервативным подходом проведено эндоскопическое введение в слизистую оболочку желудка раствора инъекционной лекарственной формы биоматериала Аллоплант «Стимулятор регенерации». Эндоскопическое исследование после ожога агрессивным веществом, основываясь на результатах экспериментального исследования, проводили в максимально ранние сроки, придерживаясь активной тактики. При этом старались максимально инсуфлировать воздух в просвет пищевода и желудка, производили промывание травмированной слизистой с целью удаления некротизированных тканей и остатков агрессивного вещества.
Большую часть больных в обеих группах составили мужчины: 10 - в первой группе и 14- во второй группе. Женщин - две, только в первой группе. Все обследованные больные были в трудоспособном возрасте. Средний возраст в контрольной группе составил 42±11 лет, а в основной группе 42 ±12 лет.
Нами также изучалась локализация и размеры поражения по данным эндоскопического исследования. При распределении больных по степени поражения руководствовались 3-х степенной классификацией (Волоцков В.И., 1988): первая степень-гиперемия, отек слизистой оболочки, вторая степень - частичное разрушение слизистой оболочки, третья степень - полное разрушение слизистой оболочки.
Таблица 2
Распределение больных с ожогами желудка по локализации и степени поражения
Признаки |
Число больных в контрольной группе | Число больных в опытной группе |
| Локализация поражения | ||
| Кардиальный отдел и дно | 8 | 12 |
| Тело желудка | 8 | 9 |
| Пилорический отдел | 11 | 14 |
| Степень поражения: | ||
| Первая (легкая) степень | 9 | 9 |
| Вторая (средняя) степень | 3 | 5 |
| Наличие дуодено-гастрального рефлюкса | 11 | 10 |
| Всего больных | 12 | 14 |
Эндоскопическая картина зоны поражения в контрольной и основной группах больных до лечения характеризовались наличием участков гиперемии, отека, эрозий и изъязвлений различных размеров и глубины, струпов. Края изъязвлений чаще подрыты с гиперемией слизистой вокруг. Дно язв и эрозий покрыто некротическими и фибринозными наложениями.
Визуальную оценку динамики восстановления слизистой оболочки желудка проводили ФГДС на 10, 20 сутки. Протокол ФЭГДС оформлялся по схеме, в которой отражается состояние слизистой оболочки пищевода, желудка и двенадцатиперстной кишки, тонус и перистальтика желудка, количество сока, слизи и их цвет, высота и эластичность складок, наличие дуоденогастрального и гастроэзофагального рефлюкса.
Для исследования динамики морфологических изменений на этапах лечения проводился забор биопсийного материала. Участки слизистой оболочки получены перед введением биоматериала, и во время сеансов контрольной фиброгастродуоденоскопии на 10 день и 20 день после начала лечения. Срезы окрашивали гематоксилином и эозином, по методу Маллори. Выраженность воспалительной реакции, атрофии в слизистой оболочке оценивались полуколичественным методом по шкале Dixon M.F. et all. (1996).
В топографо-анатомическом и клиническом разделах работы параллельно регистрировались значения тканевого напряжения в норме, на фоне патологических состояний желудка и после введения ДБА. При этом использовался метод игольной тензометрии, предложенный А.К.Макаровым (1987). В порядке комплексирования с УГАТУ была разработана регистрирующая часть аппарата и компьютерная программа «Тензометрия».
Результаты собственных исследований
Гистотопографический раздел настоящего исследования выполнен с целью морфологического обоснования технологии эндоскопического инъекционного введения диспергированной формы биоматериала в стенку желудка. Для этого требовалось решение двух взаимосвязанных задач:
- выявить, регионарные особенности фиброструктуры подслизистого слоя желудка сделав упор на плотность коллагеновых волокон и их пространственную архитектонику
- изучить вариабельность факторов ТН в различных отделах желудка человека
Известно, что указанные параметры в значительной степени определяют направленность и объем формирующегося инъекционного инфильтрата (Петров А.П., 1973)
Волокнистая соединительная ткань представлена во всех оболочках желудка: слизистой (исключая эпителиальный слой), подслизистой основе, мышечной и серозной оболочках. Однако во всех областях она имеет различное строение и взаиморасположение, что и определяет различие в распространении биоматериала в ее структурах. Для удобства сравнительного анализа полученных нами результатов, анатомо-морфологические параметры различных отделов желудка приведены в таблице 3.
|
Пространственная характеристика КВ |
Плотность пучков КВ, в % |
Значения ТН (в мм. рт.ст) |
Тип формирующегося инфильтрата при инъекции ДБА |
Кардиальный |
Поливекторная при компактном расположении волокон | 70,1±0,72 |
6,3±0,75 |
Относительно ограниченный домен с формированием инъекционного валика при введении 2 мл. ДБА |
Тело желудка |
Трехмерная при рыхлом расположении волокон | 42,2±0,75 (передняя стенка) |
3,06±0,13 (передняя стенка)
|
Формирование диффузного инфильтрата при инъекции 5-7 мл |
Пилорический |
Пластинчатая при компактном взаимноперпендикулярном расположении волокон | 80,1±0,59 |
5,75±0,20 |
Локализованный домен при инъекции 1,0-1,5 мл. ДБА |
Представленные в таблице 3 данные указывают на клинико-анатомические параллели между фиброструктурой и тензометрическими параметрами подслизистого слоя желудка с одной стороны и характером формирующегося инфильтрата с другой стороны. В частности, относительно рыхлое расположение КВ и низкое значение ТН создает условия для диффузного распространения инъецируемого биоматериала. Компактное расположение КВ во внеклеточном матриксе и более высокие показатели ТН предполагает образование строго локализованного домена ДБА, эндоскопически проявляющегося характерным валиком при минимальных объемах инъекции (1,0-1,5 мл. раствора биопрепарата).
В острых опытах на кроликах показано, что при введении в подслизистый слой уже 0,3 мл биоматериала, образуется ограниченный домен шириной 2,5 мм и высотой 2 мм, проявляющийся инъекционным валиком. При введении ДБА в мышечную оболочку фрагменты биоматериала распространяются по ходу соединительнотканных тяжей вглубь с формированием нескольких локальных доменов. Регистрация тканевого напряжения в стенке желудка кролика в норме в области тела составила 2,18(2,08÷2,27) мм.рт.ст. Инъекционное введение биоматериала в подслизистый слой приводит к достоверному повышению показателя тканевого напряжения до 2,4(2,33÷2,47) мм. рт.ст. Приведенные данные позволяют утверждать, что введение ДБА в подслизистый слой приводит к увеличению тканевого напряжения что, по-видимому, является одним из факторов реализации его биологических и гемостатических свойств. Таким образом, выполненные нами гистотопографические и биомеханические исследования желудка подтверждают теоретическую концепцию А.Г. Кочеткова с соавт.(1997), о роли мягкого остова в обеспечении подвижности органов, изменении их пространственного положения и напряженного состояния, а также служат анатомической основой для разработки эндоскопических инъекционных технологий.
Следующим этапом настоящей работы явилось изучение динамики репаративного процесса на экспериментальной модели химического ожога желудка. В контрольной серии у крыс наблюдался эрозивный гастрит с последующим формированием фиброза в области ожога. Аналогичная картина получена при экспериментальных химических ожогах на кроликах у А.И.Бориса, Г.Г.Захарова, 1975. Об этом свидетельствует динамика толщины пучков коллагеновых волокон собственной пластинки слизистой желудка. В норме она составляла 2,4±0,1. Сразу после ожога в обоих группах р>0,05, что является статистически не значимо. На 7-е сутки после ожога в опытной группе отмечается уменьшение толщины пучков коллагеновых волокон в 1,2 раза (р<0,05), на 30-е сутки этот показатель уменьшается в 1,6 (<0,05). В контрольной серии наблюдается увеличение толщины пучков коллагеновых волокон с формированием грубоволокнистой соединительной ткани. При определении количественного содержания фибробластов на единицу площади (27,8 тыс. мкм²) на 7-сутки после ожога отмечается уменьшение данного показателя в опытной группе в 1,7 раза (р<0,05), в сравнении с контрольной группой, а на 30-е сутки уже в 4,4 раза. Сразу после ожога р>0,05.
Сформированная грубоволокнистая ткань маловаскуляризирована в сравнении с рыхлой волокнистой соединительной тканью собственной пластинки. Степень васкуляризации отражает показатель площади суммарного просвета капилляров. Сразу после ожога р>0,05. На 7-е сутки после ожога в опытной группе отмечается увеличение данного показателя в 0,8 раза (р<0,05) в соавнении с контрольной группой. На 30-е сутки показатель увеличился в опытной группе 0,35 раза в опытной группе в сравнении с контрольной.
Показательной в данном экперименте является также макрофагальная реакция. При перифокальном обкалывании ДБА области поражения удлиняется макрофагальная реакция, на что указывают результаты статистической обработки данных. Сразу после ожога р>0,05. На 7-е сутки в опытной группе плотность макрофагов возросла в 0,6 (р<0,05) раза в сравнении с контрольной группой, а на 30-е сутки в 0,5(р<0,05) раза.
Известно, что макрофагальная реакция, через комплекс цитокинов, обеспечивает активацию репаративных процессов и способствует формированию адекватного регенерата (Муслимов С.А., 2002).
Для сравнительного анализа динамики регенерации, выбранные нами критерии развития фиброза, плотности органного сосудистого русла, макрофагальной инфильтрации и восстановления железистого аппарата, приводятся в сводных таблицах 4, 5.
| Серии опытов Анализируемые параметры | Контрольная группа, n=30 | Опытная группа, n=30 | Показатели в норме |
Диаметр КВ (мкм): После ожога На 7-е сутки На 30-е сутки |
3,4±0,2 4,3±0,4 5,0±0,2 |
3,4±0,1 3,5±0,2* 3,0±0,2*
|
2,4 |
Плотность фибробластов: После ожога На 7-е сутки На 30-е сутки |
174,9±11,6 157,1±5,7 131,0±6,8
|
177,0±10,9 88,7±6,1*** 29,3±6,3**
|
40,0 |
Площадь суммарного просвета капилляров: После ожога На 7-е сутки На 30-е сутки
|
559,7±7,6 332,6±6,8 113,5±8,3 |
559,7±7,8 437,7±15,8** 321,7±13,8***
|
166,9±7,8 |
Примечание: различия достоверны в сравнении с контрольной группой *- р< 0,05; **- p<0,01; ***- p<0,001.
| Срок | Контрольная серия, n=30 | Опытная серия, n=30 |
| Острый период (через час после хим. ожога) | 121,0±8,7 | 172,2±10,7 |
| На 7-е сутки | 77,0±4,3 | 136,4±6,8* |
| На 30-е сутки | 22,8±4,4 | 47,9±5,3* |
Примечание: различия достоверны в сравнении с контрольной группой *- р< 0,05.
Таким образом, перифокальное введение ДБА в область химического ожога желудка оптимизирует процессы репаративной регенерации, в эксперименте способствует формированию адекватного регенерата без явлений фиброза в стенке желудка. На основании изложенных экспериментальных данных следует заключить, что инъекции ДБА при ожогах желудка способствуют изменению характера воспалительной реакции и переходу в пролиферативную фазу, которая заканчивается формированием полноценного регенерата.
Макроскопическая динамика развития постожоговых изменений, выявляемая нами при эндоскопическом исследовании закономерна, и соответствует описанию других авторов (Кальченко И.И., Хохоля В.П., 1977; Волоцков В.И., 1988). При этом показано, что после инъекции ДБА на 10 сутки макроскопическая картина проявляется значительным уменьшением отека, формированием множественных «островков» эпителизации, очищением раневых поверхностей, появлением ограниченных гранулирующих участков. На 20-е сутки эндоскопическая картина характеризуется полным заживлением эрозивных дефектов без формирования рубцов и фиброза. Слизистая пораженной части желудка сохраняет умеренную гиперемию, вид «бархатной» поверхности, сохраняется незначительная отечность.
| Макроскопические признаки | Сроки лечения (в сутках) | Контрольная группа, n=12 | Опытная группа, n=14 | p |
| Отторжение некротических тканей | 10 20 |
5 12 |
10 14 |
0,31 0,01 |
| Сроки полной эпителизации | 10 20 |
- 7 |
3 13 |
- 0,1 |
| Формирование рубцов, деформаций | 10 20 |
- 8 |
- 4 |
- 0,12 |
Параллельно у пациентов проводилось измерение величины тканевого напряжения в различных отделах желудка. В контрольной группе эти величины колебались, в зависимости от отдела желудка от 7,340 мм. рт. ст. до 12,167 мм. рт. ст. Результаты измерения тканевого напряжения после первого введения ДБА показали достоверный его подъем в интервале от 18,634 мм. рт. ст. до 23,086 мм.рт.ст. Повторное введение препарата показало дальнейший подъем тканевого напряжения, от 16,589 мм. рт. ст. до 35,864 мм. рт. ст. Эти данные подтверждают исследования проведенные А.К. Макаровым с соавт. (1987), где подчеркивается корреляция между показателем оптимизации репаративного процесса на фоне умеренного повышения тканевого напряжения. Необходимая коррекция тканевого напряжения в предлагаемой нами методике достигается путем введения ДБА в стенку желудка.
Патоморфологическая картина соответствует приведенной выше эндоскопической динамике процесса. На 10 сутки в гистологических препаратах отмечалось значительное уменьшение воспалительного отека, выраженная мкрофагальная инфильтрация, участки регенерации эпителия. На 20 сутки в гастробиоптатах, на фоне инъекционного введения ДБА, констатируются слабые воспалительной реакции, в составе клеточного инфильтрата превалируют макрофаги, отсутствуют признаки формирования грубоволокнистой и рубцовой соединительной ткани. В целом отмечаются признаки репаративной регенерации железистого аппарата.
| Признаки | Дни |
Контрольная группа |
Опытная группа |
| Отек | 10 20 |
+ + + + + |
+ + + + |
| Плотность капиллярного русла | 10 20 |
+ + + + + |
+ + + + + + + |
| Эрозии | 10 20 |
+ + + + |
+ + - |
| Степень развития фиброза | 10 20 |
+ + + + + + + |
+ + + + |
Микроскопическую динамику показателей в контрольной и опытной группах оценивали по 4 бальной шкале: «+»- наименьшие проявления;
«+ +»- незначительные проявления; «+ + +»- выраженные проявления; «+ + + +»- ярко выраженные проявления.
Результаты собственных гистотопографических, биомеханических и экспериментально-морфологических исследований структур волокнистого остова желудка, а также опыт клинических испытаний технологии эндоскопической инъекции диспергированного биоматериала, с учетом данных литературы, позволили сформулировать концепцию взаимодействия морфо-функциональных факторов в зоне введения биопрепарата (рис.2).
Рис.2. Основные пути взаимодействия морфофункциональных факторов в технологии эндоскопической инъекции диспергированного биоматериала.
Очевидно, что в реализации репаративного процесса участвуют две системы: с одной стороны факторы тканевого ложа, с другой стороны - факторы биоматериала.
В формате настоящей работы мы не рассматриваем отдельно роли интегративных систем организма - нервной, эндокринной, иммунной, в восстановлении анатомических структур СОЖ и подлежащих тканей. Эти аспекты регенерации отражены в серии фундаментальных работ (Серов В.В., Шехтер В.Б., 1981; Крыжановский Г.Н., 2002). Мы также учитывали, что все регуляторные механизмы организменного уровня в рассматриваемой модели химического ожога желудка реализуются через тканевое ложе. Подобный подход позволяет свести все стороны репаративного процесса к двум категориям факторов: тканевому ложу и биоматериалу (рис. 4.1).
При исследовании тканевого ложа нами впервые показана ведущая роль фиброархитектоники подслизистого слоя в формировании инъекционного домена биоматериала. Кроме того, регионарные особенности волокнистого остова желудка в значительной степени определяют значения его ТН. Указанные взаимодействия в системе соединительной ткани, включая ее гистохимические компоненты (протеогликаны, гликопротеины), также представлены на рис. 2. Приведенная схема отражает корреляции структурных особенностей подслизистого слоя желудка и его тензометрических параметров, что согласуется с данными целого ряда авторов, полученных при исследовании других органов (Макаров А.К., 1987; Лебединский В.Ю., 2000; Егоров В.И. и др., 2004).
Трансплантируемый в подслизистый слой биоматериал, вступая во взаимодействие с указанными факторами тканевого ложа, оптимизирует репаративный процесс. И здесь можно говорить о многовекторном механизме. С одной стороны аллогенный биоматериал активирует макрофагальный дифферон, цитокины которого являются ведущими факторами регенерации соединительной ткани и эпителия (Пальцев М.А., Иванов А.А., 1995). Кроме того, один из протеогликановых компонентов биоматериала - гепарансульфат, описан как стимулятор регенерации сосудов и эпителия, что объясняет выявленную в нашей опытной серии высокую плотность капиллярного русла и оптимизацию репаративных процессов эпителия СОЖ и его производных (Серов В.В., Шехтер А.Б., 1981).
Убедительным доводом в пользу представляемой эндоскопической технологии является возможность моделирования тканевого напряжения, путем инъекционного введения биоматериала «Стимулятор регенерации». Данный тезис был подтвержден нами как в анатомической, так и в клинической части работы. В публикациях А.К. Макарова (1987), В.Ю.Лебединского (2000) доказано, что нормальные и повышенные значения ТН являются обязательным условием регенерации функционально адекватных структур. Следует также отметить существенную роль эпителиально-стромальных взаимоотношений в патогенезе различных поражений желудка (Пуликов А.С., 2002). Оптимизируя регенерацию соединительной ткани, ее органного сосудистого русла, биоматериалы создают условия для восстановления эпителиального покрова и его производных.
Таким образом, эндоскопическая инъекционная технология трансплантации диспергированных биоматериалов может быть успешно реализована в схеме комплексного лечения химических ожогов желудка с учетом описанных гистотопографических и биомеханических факторов. Проводимый при этом мониторинг тканевого напряжения позволяет оценить не только состояние соединительной ткани, но и динамику реперативных процессов во всех анатомических структурах желудка, а также выработать оптимальный алгоритм всего комплекса лечебно-реабилитационных мероприятий при его химических ожогах.
Заключение и практические рекомендации
Инъекционное введение диспергированной формы биоматериала «Стимулятор регенерации» в подслизистый слой стенки желудка, мобилизуя комплекс морфогенетических и биомеханических факторов, активирует процессы репаративной регенерации при его химических ожогах, и может быть использовано в схеме комплексного лечения данной патологии.
Соединительнотканные структуры стенки желудка (собственная пластинка слизистой оболочки, подслизистый слой, мышечная и серозная оболочка), формируют единый волокнистый остов органа, имеющий характерные регионарные особенности и в значительной степени определяющие уровень тканевого напряжения.
Распространение диспергированного биоматериала в интерстициальном пространстве подслизистого слоя определяется регионарными особенностями фиброархитектоники и плотностью КВ. Так для тела желудка, где превалирует рыхлое расположение КВ( до 60% площади гистотопографического препарата) характерен диффузно-инфильтративный тип распространения фрагментов биоматериала. У участках относительно компактного КВ – пилорический отдел (80%) и кардиальный отдел (70%), при введении уже 1,0 – 1,5 мл. биопрепарата образуется строго ограниченный домен, проявляющийся характерным инъекционным валиком.
Независимо от типа волокнистого остова желудка введение биоматериала в эксперименте приводит к достоверному повышению тканевого давления от 2,18 (2,08÷2,27) мм. рт. ст. до 2.4 (2,33÷ 2,47) мм. рт. ст., что является одним из факторов в реализации морфогенетического и гемостатического эффекта.
Химический (кислотный) ожог желудка в эксперименте у крыс контрольной серии приводит к глубокой деструкции слизистой оболочки с последующим развитием грубоволокнистой соединительной ткани с низкой плотностью капиллярного русла (113,5±8,3 мкм), двукратным увеличением толщины КВ (5,0±0,1мкм).
Локальные инъекции биоматериала в подслизистый слой на фоне ХОЖ оптимизирует процессы репаративной регенерации СОЖ с формированием адекватного регенерата, высокой плотностью его органных сосудов (559,7±7,6мкм²), относительно низким диаметром коллагеновых волокон (3,5±0,2мкм), количественным снижением фибробластов (88,7±6,1мкм), активизированием макрофагальной реакции (плотность макрофагов достигает 136,4±6,8).
Инъекционное введение ДБА в подслизистый слой желудка может использоваться в комплексном лечении его химических ожогов, с целью гемостаза, а также оптимизации процессов репаративной регенерации и профилактики рубцевания.
Метод эндоскопической инъекции диспергированного биоматериала «Стимулятор регенерации» рекомендуется для использования в комплексном лечении химических ожогов желудка и его осложнений.
При выполнении эндоскопических инъекционных манипуляций следует учитывать регионарные особенности фиброархитектоники и биомеханические свойства различных анатомических отделов желудка.
Тензометрия подслизистого слоя желудка с использованием игольного метода является объективным способом регистрации ТН, и может служить диагностическим критерием для оценки состояния всех гистотопографических слоев стенки органа, а также использоваться в качестве объективного мониторинга эффективности лечебно-реабелитационных мероприятий.
Литература
1. Способ лечения и профилактики рубцовых стриктур пищевода после химических ожогов / С.А. Муслимов, Р.Т.Нигматуллин, И.Ф.Хатмуллин, З.Р.Мухаметова // Официальный бюллетень «Изобретения, промышленные образцы и товарные знаки» - 2006. - № 4.
2. Роль тканевого напряжения при пересадке аллогенных трансплантатов / Р.Т. Нигматуллин, В.Г.Гафаров, Р.Ф.Галиахметов, Н.Н.Аслямов, А.Р.Мухаметов, И.Р.Ишмуратова, З.Р. Мухаметова // Материалы Российской научно-практической конференции с международным участием «Новые технологии микрохирургии глаза (актуальные вопросы морфогенеза и регенерации в офтальмохирургии)», 10-12 декабря 2007г. - Оренбург: Вестник Оренбургского государственного университета. - №78. – С.147-150.
3. Поляризационно-оптический анализ в исследовании аллогенных тканевых трансплантатов / Р.Т. Нигматуллин, В.Г.Гафаров, Р.Ф.Галиахметов, Н.Н. Аслямов, А.Е. Апрелев, З.Р. Мухаметова // Материалы докладов IX конгресса МАМ. - Ж.Морфология, Санкт-Петербург: «Эскулап», - 2008.-Т.133, - № 2. -С.95.
4. Морфологические основы применения биоматериалов аллоплант для стимуляции регенерации тканей / Р.Т.Нигматуллин, С.А.Муслимов, Л.А.Мусина, А.И.Лебедева, З.Р. Мухаметова // Материалы Всероссийской конференции с международным участием. – Россия, - Самара. - 18-20 июня 2008г. – С.85-86.
5. Мухаметова, З.Р. Стимуляция репаративной регенерации слизистой оболочки желудка и пищевода с использованием биоматериала (экспериментально-морфологическое исследование) / З.Р. Мухаметова, И.Ф. Хатмуллин // Ж.: «Морфологические ведомости» - №3 - 2009г. – С. 214-215.
ПАТЕНТЫ
1. Способ лечения и профилактики рубцовых стриктур пищевода после химических ожогов / Муслимов С.А., Хатмуллин И.Ф., Мухаметова З.Р. // Патент № 2269349. Российская Федерация. Заявка № 2004121297/14. Зарегистрировано 12.07.2004. Бюл. № 4 от 10.02.2006.
к содержанию | опубликовать статью
ВЛИЯНИЕ ИНДИВИДУАЛЬНОГО ГЛАЗНОГО ПРОТЕЗИРОВАНИЯ НА КАЧЕСТВО ЖИЗНИ БОЛЬНЫХ С АНОФТАЛЬМОМ И СУБАТРОФИЕЙ ГЛАЗНОГО ЯБЛОКА
Рыжов В. А.
Работа выполнена в ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию»
Автором составлены специальные опросники для определения качества жизни протезированных больных с анофтальмом и субатрофией глазного яблока, дающие возможность объективно определять косметический эффект глазного протезирования и качество изготовления протезов. Усовершенствована конструкция и технология изготовления пластмассовых косметических глазных протезов различных типов, что позволяет воспроизвести в толстостенном протезе рельефную радужку, глубину передней камеры, плавный лимб и ровный, интенсивно-черный зрачок «отверстие диафрагмы», а в тонкостенном протезе типа «коронка» плавный ровный лимб, ровный черный зрачок, объемную радужку при малой толщине изделия. На основании разработанной усовершенствованной технологии изготовления пластмассовых косметических глазных толстостенных и тонкостенных протезов типа «коронка» оформлен патент Российской Федерации на изобретение N 2164472 «Комплекс радужка-зрачок для глазного протеза и способ его изготовления (варианты)», зарегистрированный в Государственном реестре изобретений Российской Федерации 27 марта 2001 г. и Евразийский патент N 003287, зарегистрированный и опубликованный 24 марта 2003 г. «Комплекс радужка-зрачок для глазного протеза и способ его изготовления (варианты)».
Актуальность
Интенсивное развитие социальной и промышленной инфраструктуры, рост темпов урбанизации, увеличение плотности размещения промышленных предприятий, содержащих значительные запасы горюче-смазочных, токсических и вредных веществ, износ технологического оборудования, снижение эффективности техники безопасности способствуют образованию обширных техногенных зон повышенного риска для здоровья населения, возникновению чрезвычайных ситуаций, приводящих к большому количеству травм при авариях и катастрофах, сопровождающихся повреждением органа зрения (Ибрагимова Г.Я., Якупова Г.Б., 1999). Происходит увеличение бытового глазного травматизма, а также травматизма, связанного с применением газового оружия в целях самообороны и средства нападения (Артамонова О.В., Даутова З.А., 1999). Участились случаи криминальных травм глаз при которых нередко поражаются оба глаза, что приводит к потере зрения и инвалидности, в основном, у подростков и лиц молодого возраста. (Сулеева Б.О., Меерманова Ж.Б., Жуматаева С.З., 1999).
До настоящего времени травма органа зрения и ее последствия являются одной из основных причин слепоты. В исходе тяжелой травмы глаза у 5-12 % пациентов приходится удалять глазное яблоко из-за посттравматической субатрофии, хронического посттравматического увеита, угрозы симпатической офтальмии (Филатова И.А., 1999).
Потребность населения в глазных протезах на территории Российской Федерации, в основном, стабильный показатель.
По данным П.Г.Макарова, И.И.Грязновой и И.Ф.Романовой (1969) количество больных с анофтальмом составляет 21,0 на 10 000 населения. В пересчете на 240 миллионов населения СССР в глазном протезировании в 1969 году нуждалось около 500 тысяч человек. В лечебных учреждениях страны за год производится более 3500 энуклеаций и более 5000 человек нуждается в протезировании (Гундорова Р.А., 1980).По данным А.Н.Иванова (1991) показатель распространенности анофтальма в СССР составляет 22,3 на 10 000 населения. По данным Ю.А.Чеглакова (1995) и А.Ц.Лясковика (1997) в лечебных учреждениях Российской Федерации в удалении глазного яблока ежегодно нуждаются более 12 000 пациентов. Из них 58 % составляют лица в возрасте от 14 до 45 лет. В Республике Башкортостан энуклеаация ежегодно проводится более 300 больным (Кудоярова Э.Г., 1995). По данным министерства здравоохранения Российской Федерации, в стране ежегодно выполняются 7,5-8 тысяч энуклеаций (Филатова И.А., 2001).
В настоящее время в России в глазном протезировании нуждается около 300 000 человек.
Активно развивается хирургия анофтальма: около 20 % энуклеаций и эвисцераций глазного яблока осуществляются с формированием опорно-двигательной культи с использованием различных имплантатов, что позволяет на первых этапах после операции применять стандартные протезы среднего размера, а в дальнейшем индивидуальные продолговатые протезы по форме глазной щели, обеспечивающие оптимальное рапределение тяжести протеза частично на внутренний и наружный своды (Филатова И.А., 2002). Но требования к косметическим результатам протезирования возросли. В настоящее время пластическая хирургия анофтальма не может удовлетворяться простым стандартным подборочным глазным протезированием. При индивидуальном глазном протезировании должна учитываться в полной мере уникальность формы конъюнктивальной полости у каждого больного (Гернер М.М., Каральник Д.М., 1984, Henc-Petrinivic L., Ritz-Mutevelic L., 1991, Kazim M., Чеглаков Ю.А., Давыдов Д.В., Katowitz J.A., Piest K.L., 1992).
Технология изготовления стеклянных глазных протезов не менялась с 1898 года (Свердлов Д.Г., 1933, Шибаев А.В., 1941, Шиф Л.В., 1965, Друянова Ю.С., 1972), а пластмассовых глазных протезов практически не изменилась с 1949 года и имеет ряд недостатков: это плоская радужка с тусклым зрачком в толстостенном протезе и «размытый» лимб при «бомбажной» радужке и таком-же невыразительном зрачке в тонкостенном протезе типа «коронка» (Бетельман Л.И.; Тиссенбаум М.С., 1951, Гентова О.Е., 1968, Шкромида М.И., Мосяк М.А., 1991, Albiar E., 1992). Косметический эффект глазного протезирования должен соответствовать состоянию опорно-двигательной культи и конъюнктивальной полости у больных с анофтальмом и субатрофией глазного яблока после пластических операций, выполненных на высоком техническом уровне (Рыбак А.В., Цой Ф.И., Шиф Л.В., 1981; Кутейников А.Ф., Лопатто Ю.С., Самсонова А.С., 1984; Милюдин Е.С., 1992). В связи с этим возникает потребность в усовершенствовании технологии изготовления различных типов глазных протезов для устранения дисбаланса хирургической и глазопротезной техники. Улучшение косметического эффекта протезирования у больных с анофтальмом и субатрофией глазного яблока позволит улучшить социальную и психологическую реабилитацию (Свердлов Д.Г., Щастный Ф.Е., 1949, Шиф Л.В., 1973). Так как термин качества жизни представляет собой интегральную характеристику физического, психологического, эмоционального и социального функционирования больного, основанную на его субъективном восприятии, в настоящее время, в связи с возрастанием эстетических требований к хирургии, под социальной и психологической реабилитацией больных с анофтальмом и субатрофией глазного яблока подразумевается улучшение качества жизни протезированных больных (А.А.Новик, Т.И.Ионова, П.Кайнд, 1999).
Таким образом, несмотря на существование удовлетворительной технологии изготовления пластмассовых глазных протезов, проблема высокого косметического эффекта протезирования и связанной с этим социальной и психологической реабилитации больных с анофтальмом и субатрофией глазного яблока остается актуальной.
Цель
Разработать и внедрить новую технологию изготовления пластмассовых индивидуальных глазных протезов, обеспечивающую высокий косметический эффект и улучшение качества жизни больных с анофтальмом и субатрофией глазного яблока.
Материалы и методы исследования
За период с 2000 по 2002 год под нашим наблюдением находилось 205 больных с анофтальмом и субатрофией глазного яблока:
2000 г. - 35 (17,1 %),
2001 г. - 92 (44,9 %),
2002 г. - 78 (38,0 %).
Мужчины составляли 119 (58,8 %), женщины 86 (41,2 %).
Преимущественно под наблюдением находились лица трудоспособного возраста от 19 до 60 лет: 133 пациента (64,9 %).
Основной причиной потери глаза явились травмы и ожоги глаза - 140 лиц (68,35 %). Большую часть составили злокачественные опухоли 21 (10,20 %), вялотекущие увеиты 19 (9,26 %), глаукома 12 (5,81 %) и неизвестные причины 13 (6,38 %). Причины энуклеации регистрировались со слов больных.
Энуклеация была произведена 191 пациенту (93,18 %). В основном пациентам, протезированным нами была произведена энуклеация с формированием опорно-двигательной культи во Всероссийском центре глазной и пластической хирургии - 79 (38,53 %).
Среди 205 протезированных пациентов у 14 (6,82 %) энуклеация не была проведена. Им изготовлены тонкостенные глазные протезы типа «коронка» по поводу субатрофии глазного яблока. Склеральная часть протезов имела толщину 0,6-1,2 мм, а центральная часть 1,5-3,0 мм. 13-ти пациентам была произведена пластика по Кунту, у 11-ти передний бандаж глазного яблока.
Для оценки качества протезирования больных с анофтальмом и субатрофией глазного яблока и связанной с ним социальной и психологической реабилитации мы использовали методы: клинические, косметические, психологические и критерии оценки качества жизни.
По разделу клинических методов оценки качества протезирования глаз мы исследовали:
- состояние конъюнктивальной полости (форму, глубину ее сводов, наличие рубцов, возможность протезирования),
- качество опорно-двигательной культи (форма, расположение, округлость, поверхность, подвижность, содружественность движений культи и парного глаза).
Далее определяли симметричность протезированного и парного глаза:
- отстояние от средней линии спинки носа до края радужки,
- вертикальный и горизонтальный размеры глазной щели в мм,
- степень экзофтальма протеза в мм,
- глубину орбито-пальпебральной борозды на стороне протеза,
- наличие и степень выраженности птоза верхнего века,
- степень несмыкания век над протезом в мм,
- угол девиации протеза в градусах по Гиршбергу,
- суммарный объем движений протеза.
Для оценки косметического эффекта глазного протезирования мы определяли идентичность протеза парному глазу по: цвету радужки, зрачку, лимбу, цвету склеры, сосудистому рисунку, глубине камеры, блеску протеза.
Для оценки психологического благополучия протезированных больных мы выясняли ряд вопросов: Удовлетворяет ли косметический эффект протезирования?
Соответствует ли внешность ожидаемому результату?
Нравится ли отражение в зеркале?
Замечают ли незнакомые люди протез?
Что больше беспокоит, то что нет глаза, или нет зрения?
Радует ли до сих пор то, что радовало всегда?
Чувствуете ли себя свободно при нахождении в обществе?
Удовлетворены ли своей жизнью, нравится ли работа?
Для оценки качества жизни протезированных больных основными критериями мы выбрали степень комфортности при ношении протеза. Мы выясняли у пациентов ряд вопросов:
Бывают ли неприятные ощущения инородного тела, сухости, жжения, рези, боли на морозе, что протез может выпасть?
Как осуществляется промаргивание век над протезом?
Бывает ли отделяемое из конъюнктивальной полости, как часто, каково его количество и характер?
Зависимость от аптеки (необходимость спецмедикаментов)?
Есть ли проблемы с обработкой протеза вне дома?
В целом был составлен опросник, включающий 62 вопроса.
Исследование 205 пациентов мы осуществляли до и после индивидуального глазного протезирования (ИГП) по авторской технологии. Критерии оценки эффективности протезирования по пятибальной системе мы разделили на две группы: первую оценивал офтальмолог, вторую сам пациент. В ходе тестирования больному предлагали выразить свое отношение к каждому вопросу, выбрав один из ответов. Сумма этих баллов по всем пунктам анкеты составляет суммарный показатель «качества жизни» (КЖ), который позволяет судить о степени снижения КЖ в целом. Чем больше сумма баллов, тем выше КЖ.
Для определения вероятности обнаружения протеза посторонними наблюдателями на разных расстояниях мы провели исследование 80 пациентов, которым поочередно вставляли стеклянный протез, затем пластмассовый толстостенный, изготовленный по общепринятой технологии и пластмассовый, изготовленный по авторской технологии.Приглашенные наблюдатели (30 мужчин и 30 женщин в возрасте от 18 до 65 лет и 20 детей обоего пола от 7 до 14 лет) рассматривали глаза больных на расстояниях от 2 метров до 30 сантиметров и указывали расстояние, на котором замечали глазной протез. Для выявления существенности статистической значимости ответов по опроснику 205 пациентов до и после индивидуального глазного протезирования по авторской технологии изготовления пластмассовых глазных протезов мы провели вычисление параметрических и непараметрических статистик:
1.Вычисление параметрического критерия Стьюдента для оценки достоверности различий средних баллов.
2.Критерия Уилкоксона (непараметрический медианный «критерий сдвига»).
3.Расчет коэфициента корреляции по Пирсону с построением диаграмм рассеивания и оценкой различий корреляций по Фишеру для сравнения связанности оценок пациента и врача офтальмолога.
Результаты собственных исследований и их обсуждение
Нами разработана новая технология изготовления пластмассовых глазных протезов двух типов: толстостенные и тонкостенные типа «коронка». За основу взята общепринятая в России технология, на всех этапах которой мы предложили усовершенствования (ТУ 64 1-3393-79).
Обычно заготовку радужки изготавливают из прозрачного полиметилметакрилата, вытачивая полусферический сегмент с плоской поверхностью на которую красками наносят рисунок радужки и зрачка. Но картинка радужки плоская, зрачок сероватый, лимб неровный. Для устранения этих недостатков мы изменили способ изготовления заготовки радужки протеза, используя двухцветный двухслойный полиметилметакрилат. При помощи сферотокарных станков мы изготавливаем заготовку нужного диаметра со следующими конструктивными элементами: передняя прозрачная сфероидальная поверхность сопрягается через бортик с фаской 15 градусов с задней вогнутой торической поверхностью, в центре которой находится черный цилиндр-зрачок (рис. 1а). На торической поверхности резцом создаем радиальную исчерченность и наносим рисунок радужной оболочки масляной краской.
Далее следует изготовление гипсовой пресс-формы. Для удержания раскрашенной заготовки в пресс-форме во время прессования и полимеризации мы применяем конусовидный фиксатор. После горячей полимеризации белой стоматологической пластмассы СИНМА-М шлифуем остов протеза и наклеиваем красные шелковые нитки (имитация сосудов) на переднюю поверхность. В той же пресс-форме наполимеризовываем прозрачный слой и полируем до готового изделия.
При изготовлении тонкостенных пластмассовых глазных протезов типа «коронка» по общепринятой технологии рисунок радужки и зрачка наносят на переднюю поверхность протеза красками и покрывают слоем прозрачной пластмассы (ТУ 64 1-3393-80). Технология имеет недостатки: рисунок плоской радужки не имеет рельефа, зрачок сероватый, тусклый, лимб неровный и нечеткий, глубина передней камеры остутствует.
Рис. 1. Заготовка радужки для толстостенного (a) и тонкостенного (b) пластмассового глазного протеза
Мы используем технологию идентичную изготовлению толстостенных протезов, с той разницей, что заготовка радужки более тонкая, с размещением тонкого цилиндра-зрачка по внутреннй вогнутой сферической поверхности (рис. 1b). Преимущественные отличия авторской технологии изготовления глазных протезов от общепринятой:
1. Строго округлый зрачок имеет интенсивно-черный цвет, создает иллюзию «отверстия диафрагмы».
2. Торическая проточка заготовки радужки создает рельефность, которая усиливается радиальной исчерченностью.
3. Фаска 15 градусов позволяет добиться плавного перехода склеры в роговицу (лимба).
4. Глубину передней камеры легко регулировать, варьируя шириной бортика.
5. Использование фаски и бортика заготовки позволяет добиться игры световых бликов в углу передней камеры, как у живого глаза, что дает ощущение подвижности зрачка при рассматривании его с разных углов и направлений.
6. Тонкий слой прозрачной пластмассы перед зрачком создает ощущение толщины радужной оболочки в области зрачкового отверстия.
7. Пресс-форма используется дважды: для изготовления остова протеза и для изготовления окончательного изделия с прозрачным покрытием. Это гарантирует сохранение формы готового протеза в соответствии с подобранным эталоном или примерочной моделью.
8. Конусовидный фиксатор гарантирует правильное положение заготовки радужки в пресс-форме во время прессования пластмассы. Без такого фиксатора заготовка часто смещается, нарушая целостность и равномерность лимба протеза.
Характеристика состояния конъюнктивальной полости протезированных больных.
Общее впечатление о состоянии конъюнктивальной полости большинства больных сложилось следующее: полость с глубокими сводами (91,70%), с выпуклой (67,80%), гладкой (76,58%), центрально-расположенной (66,83 %), неравномерной (56,59%), подвижной культей (96,59 %), при отсутствии рубцов (91,70%) и птоза верхнего века (65,37%). То есть хирургическая подготовка полости была произведена, в основном, на высоком техническом уровне.
Характеристика качества глазного протезирования до индивидуального изготовления глазных протезов.
Из 205 больных, обратившихся к нам на индивидуальное глазное протезирование, пластмассовыми глазными протезами пользовались 25 лиц (12,2%), стеклянными протезами 180 (87,8%). В протезировании толстостенными глазными протезами нуждались 145 (70,7%), тонкостенными - 60 (29,3%).
Вертикальный размер глазной щели меньше у 108 лиц (52,69%), или больше на стороне протеза у 67 (32,68%).
Горизонтальный размер глазной щели уже у 124 (60,49%), или или шире на стороне протеза у 50 (24,39%).
Орбитопальпебральная борозда на стороне протеза сглажена, втянута или запавшая у 172 (83,90%).
Протез отклонен на 2-5 градусов по Гиршбергу у 23 (11,22%).
Протез или западает, или проминирует кпереди у 184 (89,76%).
Несмыкание век над протезом выражено у 50 (24,39%).
Подвижность протеза 120-140 градусов у 19 (9,27%), 60-120 градусов у 115 (56,09%), менее 60 градусов у 71 (34,64%).
Общее впечатление о качестве глазного протезирования неудовлетворительное, так как не соответствует высокому уровню параметров конъюнктивальной полости и опорно-двигательной культи.
На основании ответов 205 пациентов на 62 вопроса, разработанных нами опросных анкет до и после индивидуального глазного протезирования по авторской технологии изготовления пластмассовых глазных протезов мы провели вычисление параметрических и непараметрических статистик. Ниже представлены результаты.
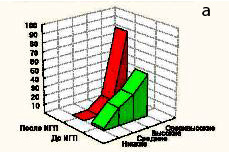
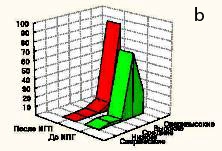
Рис. 2. Результаты комплексной оценки качества протезирования до и после индивидуального глазного протезирования (ИГП) врачом-офтальмологом (а) и пациентами (b)
На рисунке 2а средний уровень оценки эффективности протезирования офтальмологом до ИГП составлял 93 балла (Sd=21 балл, минимум 41 балл, максимум 123 балла). После ИГП по авторской технологии средний балл - 115 (Sd=14 баллов, минимум 67 баллов, максимум 128 баллов).
Различие средних баллов (22 балла) оказалось статистически значимо: t = 39 p << 0,00001.
Поскольку возникли сомнения в «нормальности» рапределения баллов эффективности протезирования было произведено сравнение по ранговому критерию Уилкоксона, не чувствительному к форме распределения. Различие по тесту Уилкоксона оказалось статистически значимо: Tz = 12,4 p << 0,00001.
Результаты теста Уилкоксона отражают существенное изменение непараметрических числовых характеристик (мода и медиана) вероятностного распределения баллов. До ИГП медиана составляла 96 баллов, мода 111 баллов. После ИГП по авторской технологии медиана составляла 122 балла, мода 127 баллов.
Таким образом, судя по результатам этих сравнений можно уверенно утверждать, что после индивидуального глазного протезирования по авторской технологии изготовления пластмассовых глазных протезов произошло существенное изменение характера распределения оценок эффективности протезирования - произошло перераспределение оценок в сторону более высоких значений, а крайне низкие оценки «переходят» в низкие на другом диапазоне распределения, что наглядно видно на рисунке 2а.
На рисунке 2b средний уровень оценки эффективности протезирования пациентами до ИГП составлял 129 баллов (Sd=20 баллов, минимум 15 баллов, максимум 170 баллов). После ИГП по авторской технологии средний балл - 154 (Sd=12 баллов, минимум 67 баллов, максимум 175 баллов). Различие средних баллов (25 баллов) оказалось статистически значимо: t = 30,5 p << 0,00001.
Различие по тесту Уилкоксона оказалось статистически значимо: Tz = 12,3 p << 0,00001.
Результаты теста Уилкоксона отражают существенное изменение непараметрических числовых характеристик вероятностного распределения баллов. До ИГП медиана составляла 133 балла, мода 134 балла. После ИГП по авторской технологии медиана составляла 156 баллов, мода 155 баллов.
Таким образом, судя по результатам сравнения, можно утверждать, что после индивидуального глазного протезирования по авторской технологии изготовления пластмассовых глазных протезов произошло существенное изменение характера распределения оценок эффективности протезирования - произошло перераспределение оценок в сторону более высоких значений с уменьшением группы крайне-низких значений, переходящих в низкие и средние, что наглядно видно на рисунке 2b.
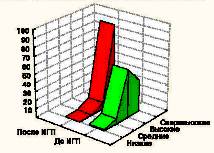
Рис.3. Средний уровень оценки «качества жизни» пациентов до и после ИГП
На рисунке 3 средний уровень оценки «качества жизни» пациентов до ИГП составлял 222 балла (Sd=36 баллов, минимум 69 баллов, максимум 282 балла). После ИГП по авторской технологии средний балл 270 (Sd=24 балла, минимум 166 баллов, максимум 298 баллов).
Различие средних баллов (48 баллов) оказалось статистически значимо: t = 39,8 p << 0,00001.
Было проведено сравнение по ранговому критерию Уилкоксона. Различие по тесту Уилкоксона оказалось статистически значимо: Tz = 12,4 p << 0,00001.
Результаты теста Уилкоксона отражают существенное изменение непараметрических числовых характеристик вероятностного распределения баллов. До ИГП медиана составляла 224 балла, причем гистограмма распределения оказалась мультимодальной.
После ИГП по авторской технологии медиана составляла 277 баллов, мода 291 балл.
Таким образом, судя по результатам сравнения, можно уверенно утверждать, что после индивидуального глазного протезирования по авторской технологии изготовления пластмассовых глазных протезов произошло существенное изменение характера распределения уровней оценок «качества жизни» пациентов - произошло перераспределение оценок в сторону высоких и «сверхвысоких» значений, а низкие оценки перешли в средние и высокие. На рисунке 3 наглядно видно, что уровень оценок «качества жизни» пациентов после индивидуального глазного протезирования по авторской технологии изготовления пластмассовых глазных протезов возрос более, чем в 2 раза, при существенном уменьшении низких оценок.
Корреляция оценок эффективности протезирования офтальмологом и пациентами до ИГП относительно невысокая (r = 0,44).
Корреляция оценок эффекта протезирования офтальмологом и пациентами после ИГП по авторской технологии возросла (r = 0,59).
На рисунке 4 по оси абсцисс - суммарные оценки «качества жизни» пациентов до ИГП, по оси ординат - суммарные оценки «качества жизни» пациентов после ИГП по авторской технологии.
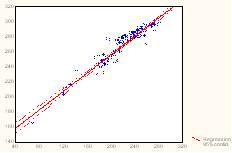
Рис. 4. Суммарные оценки "качества жизни" пациентов до ИПГ и после ИПГ по авторской технологии
Корреляция суммарной оценки «качества жизни» до и после ИГП стало предельно высокой (r = 0,91). Незначительное расхождение результатов оценок наблюдается до уровня 120 баллов. После границы 120 баллов эти расхождения исчезают на границе 160 баллов: высокие оценки «до» всегда соответствуют высоким оценкам после ИГП по авторской технологии. Это заставляет полагать, что ИГП по авторской технологии изготовления пластмассовых глазных протезов устраняет, в первую очередь, низкие и «сверхнизкие» оценки «качества жизни». Иными словами ИГП по авторской технологии существенным образом изменяет «качество жизни» протезированных пациентов, вызывая перераспределение уровня оценок в сторону высоких и «сверхвысоких» значений при одновременном резком уменьшении групп оценок с низкими и крайне-низкими значениями, то есть индивидуальное глазное протезирование по авторской технологии изготовления пластмассовых глазных протезов статистически достоверно улучшает «качество жизни» протезированных пациентов.
Результаты протезирования больных с субатрофией глазного яблока.
Субатрофия глазного яблока была у 14 пациентов (6,82%):
(7 малой и 7 средней степени). Им изготовлены протезы «коронка»:
У всех 14 пациентов:
- полная симметрия протезированного и парного глаза,
- экзофтальма протеза, птоза верхнего века и лагофтальма не было,
- полное соответствие парному глазу цвета радужки протеза, зрачка, лимба, склеры и сосудистого рисунка,
- не возникало ощущений инородного тела, рези, жжения и сухости,
- промаргивание век над протезом осуществлялось легко,
- удовлетворенность косметическим эффектом протезирования,
- полный психологический комфорт,
- у 11-ти отделяемого из полости не было, а у 3-х редко скудное,
- суммарный объем движений протеза у 10-ти 100-119 градусов, а у 4-х 120-140 градусов.
Сравнительный анализ вероятности обнаружения глазных протезов различных типов на разных расстояниях.
Рис. 5. Сравнение вероятности обнаружения глазных протезов различных типов на разных расстояниях
Проведенный анализ показал, что маскировка отсутствия глаза пластмассовым протезом, изготовленным по авторской технологии успешная на расстоянии до 0,5-0,3 метра, пластмассовыми глазными протезами, изготовленными по общепринятой технологии на расстоянии 1,0 метр, а стеклянными протезами на расстоянии 1,5 метра. Графики наглядно показывают (рис. 5), что вероятность обнаружения протеза, изготовленного по авторской технологии в 3 раза меньше, чем традиционно-изготовленного.
Заключение и практические рекомендации
Проведенный анализ имеющихся в настоящее время конструкций и технологий изготовления пластмассовых глазных протезов показал резкий дисбаланс высокого уровня хирургической техники и низкого уровня глазопротезной технологии, приводящий к недостаточной эффективности социальной и психологической реабилитации больных с анофтальмом и субатрофией глазного яблока и выявил потребность в усовершенствовании конструкции и технологии изготовления пластмассовых глазных протезов различных типов.
Усовершенствованная конструкция и технология изготовления косметических толстостенных и тонкостенных пластмассовых глазных протезов типа «коронка» имеет ряд преимуществ по сравнению с применяемой в настоящее время, которые в сумме значительно улучшают косметический эффект протезирования за счет рельефности радужки, «естественности» зрачка, плавного лимба и «игры» световых бликов в углу передней камеры протеза с удовлетворительной глубиной при минимальной толщине протеза, не приводящей к экзофтальму.
Разработанные нами критерии оценки и специальные опросники для определения качества жизни больных с анофтальмом и субатрофией глазного яблока позволяют статистически достоверно определять косметический эффект глазного протезирования, качество изготовления протезов, качество социальной и психологической реабилитации и выявлять новые требования к улучшению глазного протезирования.
Разработка и внедрение новой технологии изготовления пластмассовых индивидуальных глазных протезов позволили статистически достоверно улучшить эффективность индивидуального глазного протезирования и более, чем в 2 раза качество жизни протезированных больных с анофтальмом и субатрофией глазного яблока.
Проведенный сравнительный анализ вероятности обнаружения глазных протезов различных типов на различных расстояниях показал, что косметический дефект удовлетворительно маскируется пластмассовыми глазными протезами, изготовленными по предложенной авторской технологии на расстоянии 50-30 сантиметров, пластмассовыми глазными протезами, изготовленными по общепринятой технологии на расстоянии 1,0 метр, а стеклянными протезами на расстоянии 1,5 метра.
С целью повышения косметического эффекта протезирования больных с анофтальмом и субатрофией глазного яблока рекомендуется использовать в лабораториях индивидуального глазного протезирования предложенную авторскую технологию изготовления пластмассовых косметических индивидуальных глазных протезов различных типов.
С целью уменьшения количества вынужденных энуклеаций, связанных с невозможностью успешного протезирования косметически-неполноценных глаз из-за малой степени субатрофии рекомендуется шире внедрять в производство усовершенствованную технологию изготовления пластмассовых тонкостенных индивидуальных глазных протезов типа «коронка» с малой толщиной.
Для определения качества глазного протезирования больных с анофтальмом и субатрофией глазного яблока рекомендуется использовать в практической работе врачей-глазопротезистов разработанные нами критерии оценки эффективности глазного протезирования.
Литература
1. Реконструкция конъюнктивальной полости при анофтальме // Новые технологии микрохирургии глаза. - Оренбург, 1994. -С. 112-113. (Соавт.: Мулдашев Э.Р.,Булатов Р.Т.,Салихов А.Ю.,Кульбаев Н.Д.).
2. Аллопластическое расширение конъюнктивальной полости при анофтальмическом синдроме // Новые технологии микрохирургии глаза. - Оренбург, 1994. - С. 113-115. (Соавт.: Мулдашев Э.Р., Булатов Р.Т., Салихов А.Ю.,Кульбаев Н.Д.).
3. Способ формирования конъюнктивальной полости при врожденном анофтальме и микрофтальме // Пластическая хирургия придаточного аппарата глаза и орбиты. - Москва, 1996. -С. 65-66. (Соавт.: Салихов А.Ю., Булатов Р.Т., Мулдашев Э.Р., Кульбаев Н.Д., Деревянных С.А.).
4. Формирование опорно-двигательной культи после энуклеации глазного яблока // Актуальные проблемы современной офтальмологии. - Саратов, 1996. - С. 9-11. (Соавт.: Булатов Р.Т., Мулдашев Э.Р., Салихов А.Ю., Родионов О.В., Кульбаев Н.Д.).
5. Отсроченная имплантация опорно-двигательной культи после энуклеации глазного яблока // Актуальные проблемы современной офтальмологии. - Саратов, 1996. - С.56. (Соавт.: Булатов Р.Т., Мулдашев Э.Р., Салихов А.Ю., Кульбаев Н.Д., Родионов О.В.).
6. Организация глазного протезирования в городе с развитой промышленностью // Ерошевские чтения. - Самара, 1997. - С. 277-279.
7. Опыт глазного протезирования после операций ревитализации глазного ябока // Ерошевские чтения. - Самара, 1997. - С. 279-280.
8. Применение пластиковых офтальмологических фантомов в учебно-методической работе // Вопросы оперативной микрохирургии и микрохирургической анатомии. - Оренбург, 1997. - С. 61-62.
9. Опыт применения пластмассовых тонкостенных лечебных окончатых глазных протезов при операциях устранения симблефарона // Вопросы оперативной микрохирургии и микрохирургической анатомии. - Оренбург, 1997. - С. 62-63. (Соавт.: Салихов А.Ю.).
10.Опыт использования чечевицеобразных лечебных протезов для формирования конъюнктивальной полости // I Евро-Азиатская конференция по офтальмохирургии. - Екатеринбург, 1998. - С. 121-122. (Соавт.: Салихов А.Ю., Кульбаев Н.Д.).
11.Психологические аспекты применения пластиковых глазных фантомов при изучении офтальмологии // I Евро-азиатская конференция по офтальмологии. - Екатерибург, 1998. - С.164. (Соавт.: Салихов А.Ю.).
12. Реконструкция переднего отдела глаза у больных с врожденным микрофтальмом // Шестая научно-практическая конференция по вопросам лечения заболеваний органа зрения. - Екатеринбург, 1998. - С. 99. (Соавт.: Родионов О.В., Булатов Р.Т., Галимова Л.Ф., Султанов Р.З., Ларин А.И.).
13.Психологические аспекты применения пластиковых глазных фантомов при изучении офтальмологии // Шестая научно-практическая конференция по вопросам лечения заболеваний органа зрения. - Екатеринбург, 1998. - С.104-105. (Соавт.: Салихов А.Ю.).
14.Опыт применения специальных косметических глазных протезов при заборе донорских глаз // Шестая научно-практическая конференция по вопросам лечения заболеваний органа зрения. - Екатеринбург, 1998. - С. 106-107. (Соавт.: Кульбаев Н.Д., Чернов Н.В.).
15.Формирование опорно-двигательной культи после энуклеации глазного яблока // Медико-социальная реабилитация офтальмологических больных. - Тюмень, 1998. - С. 37-38. (Соавт.: Булатов Р.Т., Мулдашев Э.Р., Салихов А.Ю., Родионов О.В., Кульбаев Н.Д.).
16.Отсроченная имплантация опорно-двигательной культи материалом серии «Аллоплант» при анофтальме // Медико-социальная реабилитация офтальмологических больных. - Тюмень, 1998. - С. 38-39. (Соавт.: Мулдашев Э.Р.,Салихов А.Ю., Булатов Р.Т., Кульбаев Н.Д.).
17.Результаты клинико-морфологических исследований биоматериала Аллоплант для создания опорно-двигательной культи при анофтальме // 7-ая научно-практическая конференция. - Екатеринбург, 1999. - С. 86-87. (Соавт.: Нигматуллин Р.Т., Искандеров Г.Ф., Кульбаев Н.Д.).
18.Возможные пути оптимизации полимерных глазных протезов // 7-ая научно-практическая конференция. - Екатеринбург, 1999. - С. 113-115. (Соавт.: Салихов А.Ю., Кульбаев Н.Д.).
19.Косметические результаты хирургического лечения посттравматической субатрофии глазного яблока с применением биоматериалов «Аллоплант» и с последующим протезированием // Вестник офтальмологии. Т.116, N 6. - Москва, 2000. - С.28-31.(Соавт.: Галимова Л.Ф., Мулдашев Э.Р., Муслимов С.А., Сибиряк С.В.).
20.Опыт применения пустотелых пластмассовых глазных протезов // Вторая Евро-Азиатская конференция по офтальмологии. - Екатеринбург, 2001. - С. 271-272. (Соавт.: Салихов А.Ю., Султанов Р.З.).
21.Объемное бандажирование глазного яблока при субатрофии глазного яблока // Новые технологии микрохирургии глаза. - Оренбург, 2001. - С.178-179. (Соавт.: Булатов Р.Т., Родионов О.В., Галимова Л.Ф.).
22.Способ хирургической коррекции конъюнктивальной полости при микрофтальме // Материалы XII научно-практической конференции «Новые технологии микрохирургии глаза». - Оренбург, 2001. - С. 179-182. (Соавт.: Булатов Р.Т., Родионов О.В.).
23. Профилактика синдрома моторной десинхронизации опорно-двигательной культи при энуклеации // Материалы XII научно-практической конференции «Новые технологии микрохирургии глаза». - Оренбург, 2001.- С.182-183.(Соавт.: Булатов Р.Т., Родионов О.В., Кульбаев Н.Д.)
24. Особенности социальной реабилитации больных с анофтальмом престарелого возраста // Ерошевские чтения. / Под редакцией Г.П.Котельникова. - Самара: «Офорт»; СамГМУ, 2002. - С.346-348. (Соавт.: Салихов А.Ю., Кульбаев Н.Д., Нураева А.Б.).
25. Перспективы развития глазного протезирования в начале XXI века // Офтальмология в начале XXI века / Под редакцией проф. В.В. Бакуткина. - Саратов, издательство «Светопись», 2002. - С435-438. (Соавт.: Салихов А.Ю., Султанов Р.З., Кульбаев Н.Д., Камалова Л.Р.).
26. Комплекс радужка-зрачок для глазного протеза и способ его изготовления (варианты). Патент Российской Федерации на изобретение N 2164472, зарегистрированный в Государственном реестре изобретений РФ 27 марта 2001. (Соавт.: Тимохин Г.И.).
27. Комплекс радужка-зрачок для глазного протеза и способ его изготовления (варианты). Евразийский патент N 003287, зарегистрированный и опубликованный 24 марта 2003. (Соавт.: Тимохин Г.И.).
28. Применение стоматологического бестеневого осветителя для освещения рабочего поля на сферотокарных станках при изготовлении контактных линз. Рацпредложение. Удостоверение N 11 от 08.10.85 г. Выдано больницей N 10, г.Уфа.
29. Способ экономии воска при полировании жестких контактных линз. Рацпредложение. Удостоверение N 16 от 28.10.85 г. Выдано больницей N 10, г.Уфа.
30. Способ изготовления зрачка на пластмассовых протезах. Рацпредложение. Удостоверение N 18 от 28.10.85 г. Выдано больницей N 10, г.Уфа.
31. Способ оптимизации глазного протезирования при операциях формирования конъюнктивальной полости. Рацпредложение. Удостоверение N 21 от 19.11.85 г. Выдано больницей N 10, г.Уфа.
32. Способ блефарорафии. Рацпредложение. Удостоверение N 23 от 19.11.85 г. Выдано больницей N 10, г.Уфа.
33. Способ изготовления комплекса радужки-роговицы в пластмассовых глазных протезах. Рацпредложение. Удостоверение N 33 от 10.12.85 г. Выдано больницей N 10, г.Уфа.
34. Способ покрытия пластмассовых глазных протезов прозрачной бесцветной пластмассой. Рацпредложение. Удостоверение N 34 от 10.12.85 г. Выдано больницей N 10, г.Уфа.
35. Способ формирования объемности изображения комплекса радужки-роговицы для пластмассовых глазных протезов. Рацпредложение. Удостоверение N 35 от 10.12.85 г. Выдано больницей N 10, г.Уфа.
36. Аллотрансплантат для каркасной пластики и замещения объемных дефектов в хирургии. Рацпредложение. Удостоверение N 69 от 02.12.86 г. Выдано больницей N 10, г.Уфа.
37. Применение аллосухожильных нитей для перекрестной фиксации прямых мышц глазного яблока над опорно-двигательной культей. Рацпредложение. Удостоверение N 14 от 18.05.93 г. Выдано ВЦГиПХ.
38.Применение аллосухожильных нитей для фиксации прямых мышц глазного яблока и опорно-двигательной культи. Рацпредложение. Удостоверение N 15 от 18.05.93 г. Выдано ВЦГиПХ.
39.Применение аллосухожильных нитей для ушивания теноновой капсулы при первичной и отсроченной имплантации опорно-двигательной культи. Рацпредложение. Удостоверение N 18 от 01.11.93 г. Выдано ВЦГиПХ.
к содержанию | опубликовать статью
СОЧЕТАННАЯ РЕВАСКУЛЯРИЗИРУЮЩАЯ ОПЕРАЦИЯ В ЛЕЧЕНИИ ДИАБЕТИЧЕСКОЙ РЕТИНОПАТИИ
Родионов О.В., Ларин А. И.
Работа выполнена во Всероссийском центре глазной и пластической хирургии
На экспериментальной модели гемофтальма обосновано сочетанное применение операций реваскуляризирующего типа с использованием биоматериалов Аллоплант. Показано, что данные операции способствуют ускоренному рассасыванию внутриглазных кровоизлияний при одновременном восстановлении ультраструктуры клеточных элементов сетчатки. Установлены показания и относительные противопоказания для проведения сочетанных реваскуляризирующих операций у больных диабетической ретинопатией, изучена их клиническая эффективность.
Актуальность темы
Около 3-5 % населения земного шара страдает сахарным диабетом – болезнью, причиной которой является нарушение углеводного обмена (Кохен, 1997; Осыховский А.Л. с соавт., 2000). Успехи терапии СД, как это ни парадоксально, наряду с продлением жизни больных привели к увеличению сосудистых осложнений этого заболевания. Одним из проявлений сосудистых осложнений диабета является диабетическая ретинопатия. Она имеет место, в зависимости от тяжести и давности диабета, в 10-100% (Примаков Ф.Д., 1968; Трахтенберг С.Б., 1995; Кацнельсон Л.А., Никольская В.В., Лысенко В.С., 1995; Либман Е.С., Шахова Е.В., 2000; Баранова В.П. с соавт., 2000; Скоробогатова Е.С., 2000; Пименов И.В. с соавт., 2000; Kristinsson J.K. et al., 1994; Abrahamian H. et al., 1994; Kokkonen J. et al., 1994). Причиной снижения и потери зрительных функций при ДР являются отечно-геморрагический синдром, проявляющийся в появлении макулярного отека, кровоизлияний различной степени выраженности и синдром витреоретинальной пролиферации с образованием ретинальных, преретинальных мембран, шварт и фиброза стекловидного тела (Joondeph B.C., Blankenship G.W., 1989). Указанные явления привели к слепоте лиц, страдающих СД до 10 лет в 1,8% - 4,8% случаев, а резкое снижение зрительных функций имели 9,4% - 23,9% больных этой группы (Либман Е.С., Шахова Е.В., 2000; Баранова В.П. с соавт., 2000; Скоробогатова Е.С., 2000; Пименов И.В. с соавт., 2000; Moss S.E., Klein R., Klein B.E., 1994). В США из-за прогрессивного развития диабетической ретинопатии ежегодно теряет зрение 40 тыс. человек (Morb. Mortal. Wkly. Rep., 1993), при этом диабетическое поражение глаз является ведущей причиной слепоты в возрастной группе от 20 до 74 лет, а риск потери зрения в 25 раз выше, чем в общей популяции.
Лечение ДР, несмотря на исследования и достижения в этой области, остается актуальной проблемой. Это обусловлено тем, что количество больных с указанной патологией увеличивается из года в год - с одной стороны; а с другой - совершенствуются знания о патогенезе ДР и открываются новые перспективы в лечении (Кацнельсон Л.А., Никольская В.В., Лысенко В.С., 1995), и, в-третьих, появились новые технические устройства (лазер, витреотом).
Широко распространенная в 70-80-х годах медикаментозная терапия (Кашинцева Л.Т., 1975; Белоус В.И., 1981; Гольцева С.В., 1983; Салдан И.Р., 1984; Данилова А.И., Ефимов А.С., 1985; Кашинцева Л.Т., Козина Л.В., Миленькая Т.М., 1985; Полунин Г.С., Симонова К.К., Пирогова Е.П., 1986; Белоус В.И., Подвысоцкая М.И., 1987; Сакало Е.А., Малыжев В.А., Данилова А.И., 1988; Ченцова О.Б., Можеренков В.П., Калинин А.П., 1988; Сакало Е.А., 1989; Пирогова Е.П., 1989; Белоус В.И., Юмашева А.А., 1990; Данилова А.И., Муха А.И., 1990; Косанович М., 1992; ДаниличевВ.Ф., 1996; Kosanovic M., 1989) не оправдала возлагаемых на нее надежд. Впоследствии, в рандомизированных исследованиях было показано, что лекарственные препараты оказывают симптоматическое действие и не влияют на прогноз ДР (Кацнельсон Л.А., 1995; Кацнельсон Л.А., Никольская В.В., Лысенко В.C., 1995; ETDRS Report Number 8, 1991; Belgian Ticlopidine Retinopathy Study Group 1992; Flynn H.W. et al., 1992; Sonkin P.L. et al., 1993; Steele J.W., 1993).
Применение лазера в офтальмологии принесло определенный прогресс в лечение начальных стадий ДР. Достаточно эффективна лазерная терапия при макулярном отеке и предупреждении тяжелых ретинальных осложнений ( Магарамов Д.А. с соавт., 1988; Ромашенко Ф.А., Плюхова О.А., 1988; Салдан И.Р., 1989; Семенова Т.Н., 1989; Иванишко Ю.А., Бочкарева А.А., 1990; Гойдин А. П., 2000; Ермакова Н.А. с соавт., 2000; Нестеров А.П., 2000; Нудьга Л.И., 2000; Экгардт В.Ф., Троицкова Е.В., Ефимова Е.А., 2000; Kieselbach G.F., 1988). Применение лазера на поздних стадиях развития ретинопатии малоэффективно. Кроме того, при помутнении хрусталика, стекловидного тела и наличии гемофтальма лазеркоагуляция невозможна (Иванишко Ю.А., Бочкарев А.А., Темиров Н.Э., 1988).
Воздействие холодом (криокоагуляция) на периферические отделы сетчатки, на определенном этапе знаний патогенеза ДР и при отсутствии иных технических средств воздействия, применяли достаточно часто (Кривицкий А.К., Миленькая Т.М., 1990; Кацнельсон Л.А., 1995; Нестеров А.П., 2000; Benedett R. et al., 1987; Ross W.H., Gottner M.J., 1988). Однако, результаты криокоагуляции не всегда удовлетворяют исследователей и не дают должного клинического эффекта, так как это воздействие нередко приводит к нарушению гематоофтальмического барьера и активации пролиферативного процесса (De Bara R. et al., 1989; Ando N. et al. , 1991).
Значительный прогресс в лечении ДР был достигнут в связи с разработкой витреотома и технологии его использования. Указанный метод лечения позволяет механически удалить непрозрачное стекловидное тело, преретинальные шварты, пленки и восстановить прозрачность в полости стекловидного тела (Глинчук Я.И., Семенов А.Д., Захаров В.Д., 1981; Федоров С.Н. с соавт., 1982; Деев Л.А., 1986; Мачехин В.А., Белянин А.Ф., 1987; Глинчук Я.И. с соавт., 1988; Глинчук Я.И., Шамсиев А.С., 1990; Глинчук Я.И. с соавт., 1993; Глинчук Я.И., Киселев А.В., 1995; Глинчук Я.И. с соавт., 1995; Федоров С.Н., Метаев С.А., Шкворченко Д.О., 1999; Костин О.А., Тахчиди Х.П., 2000; Сдобникова С.В. с соавт., 2000; Стебнев С.Д., 2000; Столяренко Г.Е. с соавт., 2000; Тахчиди Х.П., Уласевич О.А., 2000; Унгурьянова О.В. с соавт., 2000; Югай А.Г. с соавт., 2000; Laatikainen L., Summanen P., 1989; Lewis H. et al., 1992; Nakazawa A. et al., 1993; Jaakkola A. et al., 1993; Grewing R., Mester U., 1994; Chaudhry N.A. et al., 1995). В отдельных случаях (шварты стекловидного тела с витреоретинальной тракцией) витрэктомия является единственным эффективным способом лечения. Данная операция сопровождается вторжением в полость глазного яблока и поэтому имеет значительное количество осложнений, наиболее тяжелыми из которых являются: отслойка сетчатки, ятрогенные внутриглазные кровоизлияния, катаракта и т.д. (Гундорова Р.А. с соавт., 1985; Ковалев А.И., 1985; Логай И.М., Боброва Н.Ф., 1985; Мачехин В.А., Белянин А.Ф., 1987; Глинчук Я.И. с соавт., 1993; Tolentino F.I. et al., 1989; Lewis H., et al., 1992; Kreiger A.E., 1993; Nakazava M. et al., 1993; Karel I., Kalvodova B., 1994).
Учитывая широту факторов патогенеза ДР, естественно, ни один из этих методов не может быть признан универсальным, каждый из них применим только на определенных стадиях заболевания. Все это заставляет исследователей искать новые подходы к лечению этой тяжелой патологии.
В этой связи, учитывая механизм развития ретинопатии, наше внимание привлекли операции реваскуляризация хориоидеи (РВХ) эписклерально-сосудистым лоскутом и биоматериалом « Аллоплант» и операция лечебного ретросклеропломбирования (ЛРСП). Первая из указанных операций предложена В.У. Галимовой, Э.Р. Мулдашевым, Р.Т. Нигматуллиным в 1979 году для лечения дистрофически-дегенеративных заболеваний глазного дна: пигментная, сенильная дистрофия сетчатки и т.д. (Галимова В.У., Мулдашев Э.Р., 1979; Галимова В.У., Иванова Т.С., 1981; Мулдашев Э.Р., Галимова В.У., Нигматуллин Р.Т., 1981; Галимова В.У., 1994). В последующем, с целью компенсации нарушений микрогемоциркуляции и тканной гипоксии при ДР, Э.Р.Мулдашев, О.В. Родионов (1994), О.В. Родионов (1998, 2000) применили указанную операцию при лечении отечно-геморрагических форм диабетической ретинопатии и отметили повышение зрительных функций, улучшение прозрачности стекловидного тела за счет рассасывания гемофтальма, плазморрагий. Диабетическая ретинопатия после операции РВХ имеет более доброкачественное течение. Экспериментальные исследования (Галимова В.У., Мулдашев Э.Р., 1979; Галимова В.У., Иванова Т.С., 1981; Водовозов А.М. с соавт., 1995; Шуркин В.И., 1995; Шуркин В.И., Нагорный Р.П., 1995; Мулдашев Э.Р., Родионов О.В., Султанов Р.З., 1996; Родионов О.В., 1998; Мулдашев Э.Р., Родионов О.В., 2000) показали, что при операции РВХ формируется выраженный сосудистый анастомоз между сосудами эписклеры и сосудистой оболочкой глаза. Установлена также тесная морфо-функциональная связь между сетчаткой, хориоидеей и стекловидным телом, что и обеспечивает позитивный результат хирургического вмешательства. Применяемый при этой операции специально обработанный трансплантат существенно повышает результативность хирургического вмешательства (Мулдашев Э.Р., 1994).
Операция ЛРСП для лечения больных диабетической ретинопатией была предложена Э.Р. Мулдашевым, О.В. Родионовым, Р.З. Султановым в 1994 году. Авторами показано, что введение мелкодисперсного аллотрансплантата в субтеноново пространство приводит к активизации кровотока в эписклеральных сосудах, формированию богато васкуляризированного регенерата в заднем отделе глазного яблока. Указанные морфологические изменения способствовали рассасыванию гемо- и плазморрагий на глазном дне и в стекловидном теле, что обусловило повышение зрительных функций у больных с ДР (Султанов Р.З., 2000). Однако эффект от указанной операции был более выражен в сроки наблюдения до 1,5 лет. В последующем зрительные функции снижались, но превышали дооперационные показатели. Исходя из вышесказанного, представляет научный и практический интерес изучить состояние зрительных функций, показателей зрительной системы при сочетанном применении операции РВХ и ЛРСП.
Цель
Определить возможность применения и оценить клиническую эффективность сочетанного применения операции реваскуляризации хориоидеи и лечебного ретросклеропломбирования с использованием биологического материала «Аллоплант» при лечении ДР.
Материалы и методы исследования
Экспериментально-морфологические исследования проведены на 18 пигментированных кроликах со сроками наблюдения от 7 до 180 суток с моделированием внутриглазного кровоизлияния и проведением сочетанной реваскуляризирующей операции. Использованы гистологические и электронно-микроскопические методы иследованния.
Клинические исследования проведены на материале 120 больных (151 глаз) диабетической ретинопатией и распределились в контрольной группе: ДНР – 22 глаза, ДППР – 19 глаз, ДПР – 33 глаза. В опытной группе распределение по стадиям заболевания было следующим: ДНР – 8 глаз, ДППР – 20 глаз, ДПР – 49 глаз. Сроки наблюдения от 7 суток до 3-х лет. Использованы общепринятые методы офтальмологического исследования, объективно характеризующие состояние зрительной системы. Во всех исследуемых группах преобладали женщины, с первым типом сахарного диабета, с давностью выявленного СД от 13,5±1,43 лет до 18,9±3,61, преимущественно в стадии нестойкой субкомпенсации. Несмотря на ранее проведенное медикаментозное, лазерное или хирургическое лечение, подавляющая часть больных имела прогрессивное снижение зрительных функций с годовым градиентом от 0,29±0,06 до 0,44±0,13. Давность падения зрительных функций колебалась от 3,18±0,39 до 1,24±0,24 лет до момента операции.
Больным контрольной группы проведена операция реваскуляризация хориоидеи, а исследуемой - сочетание вышеуказанной операции с лечебным ретросклеропломбированием.
Результаты собственных исследований
Результаты экспериментально - морфологических исследований показали, что при моделировании гемофтальма введением 0,3 мм аутологичной крови отмечены значительные изменения как в стекловидном теле, так и в различных отделах сетчатки. Реакция стекловидного тела характеризовалась формированием помутнений, пленчатых фиброзных образований, снижающих оптические свойства стекловидного тела. Изменения в сетчатке обнаруживали в клетках пигментного эпителия. Отмечена выраженная деструкция митохондрий в виде набухания, нарушения структуры цитоскелета и разрушения крист. Наблюдали расширение цистерн гладкого и гранулярного эндоплазматического ретикулумов, уменьшалось количество рибосом. Исчезали складчатые выросты на базальной поверхности клеток пигментного эпителия, что в свою очередь нарушало связь указанных клеток с мембраной Бруха. Имело место укорочение и деградация апикальных микровилл, что означало локальную отслойку сетчатки. Нарушения коснулись и наружных сегментов фоторецепторов, и характера упаковки мембранных дисков, происходила деградация межфоторецепторного матрикса. Все эти изменения были характерны для сроков наблюдения 7-14 суток. В последующие сроки наблюдения (30-90 суток) нами отмечены деструктивные изменения в нейронах внутреннего ядерного слоя, в Мюллеровых глиоцитах.
Указанные патоморфологические изменения выявлялись уже на седьмые сутки наблюдения и достигали своего апогея к 90-м суткам эксперимента. Проведение сочетанных реваскуляризирующих операций на модели экспериментального гемофтальма приводило в ранние сроки наблюдения (7 сутки) к клеточной инфильтрации биоматериала. Отмечена гомогенизация коллагеновых волокон аллотрансплантата с обильной инфильтрацией макрофагами и фибробластами. К 30-м суткам после операции в резорбируемом биоматериале обнаруживались кровеносные капилляры, новообразованные коллагеновые волокна. Дальнейшая резорбция аллотрансплантата сопровождалась формированием на его месте рыхлой соединительной ткани с развитым микрососудистым руслом. Таким образом, формировался анастомоз «сосудистая сеть эписклеры - хориоидея».
Характерной реакцией со стороны стекловидного тела у животных с экспериментальным гемофтальмом и проведенными сочетанными реваскуляризирующими операциями явилась полная резорбция элементов крови без формирования помутнений и пленчатых структур. Реакция внутренних оболочек глаза, в частности, сетчатки, также была менее выражена и протекала в более короткие сроки в экспериментальной группе животных. Мы отметили восстановление складчатых выростов на базальной поверхности клеток пигментного эпителия уже в ранние сроки наблюдения. К 14-30 суткам отмечено восстановление органелл цитоплазмы. Появление значительного количества митохондрий свидетельствовало о восстановлении энергетического потенциала клеток. В эти же сроки происходило восстановление морфо-функциональных связей клеток пигментного эпителия с наружными сегментами фоторецепторов. В сроки от 30 до 90 суток практически полностью исчезали морфологические признаки внутриклеточной деградации. Восстановление ультраструктуры клеток сетчатки в опытной группе происходило в следующей последовательности: клетки пигментного эпителия – фоторецепторы – Мюллеровы глиоциты – ассоциативные нейроны.
Результаты клинических наблюдений за больными группы ДНР-РВХ показали, что острота зрения с исходной 0,25±0,07 повысилась уже к 14 суткам до 0,33±0,09 (рис. 1).
Рис. 1. Динамика остроты зрения у больных непролиферативной диабетической ретинопатией основной и контрольной групп до и после хирургического лечения
До срока наблюдения 90 суток имелась тенденция к повышению зрительных функций: острота зрения превышала дооперационную и составила 0,49±0,09, что в относительных единицах выразилось в 196%. С 360 суток отмечено некоторое снижение зрительных функций до 0,42±0,09. К концу срока наблюдения (3 года) острота зрения составила 0,29±0,07, что превышало дооперационный уровень в 1,16 раза. При этом, в 54,55% случаях острота зрения превышала, а в 45,45% находилась на дооперационном уровне. В отличие от контрольной группы, исходная острота зрения в группе ДНР-РВХ+РСП составила 0,09±0,03, но также как и в контрольной группе повышалась до срока наблюдения 90-180 суток, где составила 0,44±0,09, что в относительных единицах – 488,88%. При этом, в срок наблюдения 90 суток, зрительные функции всех оперированных глаз превышали дооперационный уровень. Некоторое снижение остроты зрения отмечено в сроки наблюдения 1-3 года. К концу наблюдения острота зрения составила 0,13±0,05, что на 144,44% превышало дооперационные значения. При этом, ни у одного больного острота зрения не была ниже исходной, 75% имели более высокое зрение, а 25% - на дооперационном уровне. Сравнивая эти показатели в контрольной и исследуемой группах можно отметить, что более выраженное повышение остроты зрения имеет место при сочетанном применении реваскуляризирующих операций. Более высок в исследуемой группе и качественный показатель: к концу срока наблюдения более высокую, по сравнению с дооперационной, остроту зрения имеет 75% оперированных глаз, тогда как в контрольной только 54,55%.
Процесс повышения остроты зрения сопровождался повышением прозрачности стекловидного тела (рис. 2, 3) и снижением выраженности ОГС (рис. 4, 5) как в контрольной, так и в исследуемой группах. Состояние стекловидного тела в контрольной группе, до операции оценивалась нами в 1,27±0,79 балла, степень выраженности ОГС в 2,1±0,7 балла, а в исследуемой - 1,25±1,26 и 2,5±0,58 балла, соответственно. Максимальное снижение показателя прозрачности стекловидного тела в контрольной группе, нами отмечено в срок наблюдения 6 месяцев(0,18±0,041 балла), а снижение показателя ОГС - к 90 суткам наблюдения (0,27±0,05 балла). При этом, в указанные сроки в 72,73% оперированных глазах стекловидное тело было более прозрачным, чем до операции, а ОГС был менее выражен абсолютно во всех глазах. К концу срока наблюдения (3 года) показатель состояния стекловидного тела контрольной группы составил 0,18±0,04, что в 1,43 раза лучше дооперационного значения (1,27±0,19). К концу исследования несколько поднялся показатель степени выраженности ОГС – 0,55±0,05, однако, у всех оперированных больных ОГС находился ниже дооперационного. В исследуемой группе к 1 месяцу наблюдения стекловидное тело становилось абсолютно прозрачным, и оценено было нами в “0” баллов, а показатель ОГС снизился до нулевой отметки к 6 месяцу наблюдения с последующим подъемом, достигающего максимальных значений к 3 году наблюдений (0,59±0,049 балла).
Рис. 2. Состояние оптических свойств стекловидного тела в контрольной группе при всех стадиях заболевания (в абс. ед.)
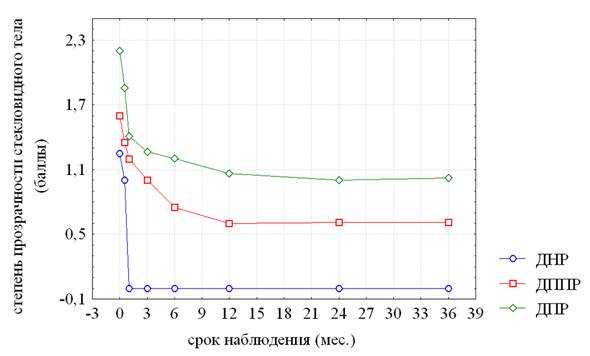
Рис. 3. Состояние оптических свойств стекловидного тела в исследуемой группе при всех стадиях заболевания (в абс. ед.)
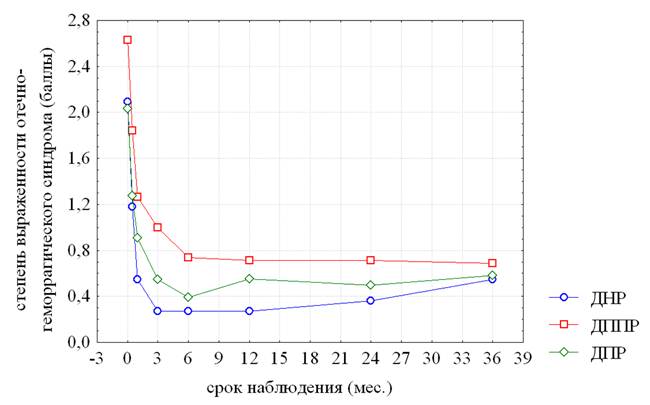
Рис. 4. Степень выраженности отечно-геморрагического синдрома в контрольной группе при всех стадиях заболевания (в абс. ед.)
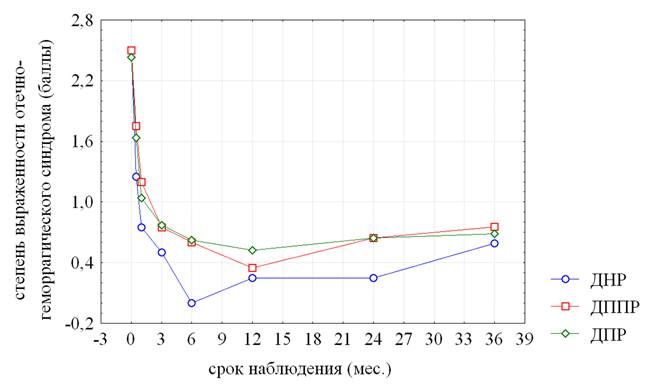
Рис. 5. Степень выраженности отечно-геморрагического синдрома в исследуемой группе при всех стадиях заболевания (в абс. ед.).
Проводя сравнительный анализ результатов операций контрольной и исследуемой групп мы также отмечаем более высокий эффект сочетанных реваскулязирующих операций. Отсутствовали достоверно значимые изменения состояния полей зрения, однако, по данным компьютерной периметрии, имело место улучшение центрального отдела (300) сетчатки, и уменьшение площади относительных скотом. Значимые изменения прозрачности хрусталика зарегистрированы только в сроки 1,2 и 3 года в контрольной группе, где он возрос с 1,0 балла (до операции) до 1,55 к концу срока наблюдения. В исследуемой группе прозрачность хрусталика достоверно не изменилась. Офтальмоскопические изменения состояния глазного дна пациентов контрольной группы, также зарегистрированы нами к 6 месяцу, где он составил 2,36 балла (дооперационный – 2 балла), к концу срока наблюдения - 3,18 балла. Аналогичная картина отслежена нами и в исследуемой группе, где экспертный ранговый показатель состояния глазного дна возрос с 2 баллов (до операции) до 3,51 балла в срок наблюдения три года. Изменение офтальмоскопической картины глазного дна и некоторое снижение зрительных функций, от максимальных значений в середине наблюдения до более низких к концу наблюдения, достаточно убедительно отражают электрофизиологические показатели. Электрочувствительность в контрольной группе, составляющая в начале исследования 119±62,23 мкВ, имела тенденцию к повышению во все сроки, однако, достоверные изменения отмечены только в 36 месячный срок, где он составил 194,09±137,35 мкВ. Этот же показатель в основной группе также имел тенденцию к повышению. До операции он составил 87,5±28,72 мкВ, а к концу наблюдения - 144,58±74,96 мкВ. Электролабильность достоверно не изменилась как в контрольной, так и в основной группах. До хирургического лечения он находился на уровне 38,18±10,14 Гц и 40±1,41 Гц соответственно, а в конце наблюдения 37,73±16,04 Гц и 46,61±5,44 Гц. Показатели внутриглазного давления, С и F колебались, однако, не выходили за рамки физиологических норм.
В группе больных с препролиферативной диабетической ретинопатией, перенесших операцию реваскуляризацию хориоидеи, повышение остроты зрения до максимальных значений отмечено нами в срок наблюдения 1 год, где она составила 0,17±0,032 (дооперационный показатель – 0,08±0,03) (рис.6).
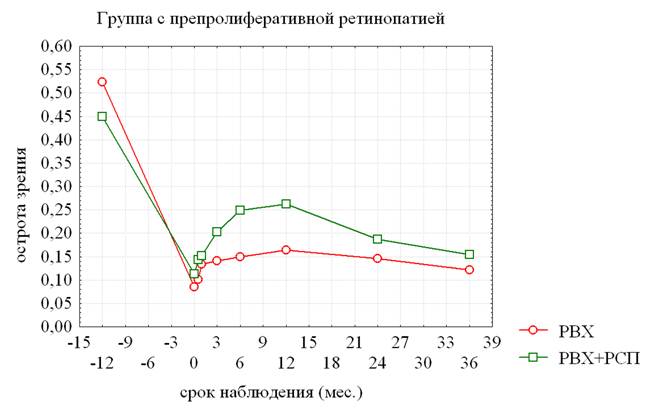
Рис. 6. Динамика остроты зрения у больных препролиферативной диабетической ретинопатией основной и контрольной групп до и после хирургического лечения
До этого срока имело место плавное повышение остроты зрения, в среднем, на 0,02 в каждый срок. К одному году острота зрения превышала дооперационный уровень, в среднем, на 212,5%, а распределение больных по признаку “лучше – без изменений - хуже”: 68,42% \ 15,79% \ 15,79%, соответственно. В исследуемой группе, где больным была выполнена сочетанная реваскуляризирующая операция, максимальный подъем остроты зрения отмечен нами к 6-12 месяцу, где указанный показатель в абсолютных значениях был равен 0,26±0,04 (относительный 236,4%). При этом остроту зрения выше дооперационного уровня имели 80% больных, на дооперационном уровне 15% и падение зрительных функций отмечено у 5% больных. В последующие сроки наблюдения нами отмечено снижение остроты зрения, которое достигло в контрольной группе к 3 году наблюдения 0,13±0,036, а в исследуемой - 0,15±0,05. При этом распределение больных по признаку “лучше – без изменений - хуже” в контрольной группе 57,87% \ 10,53% \ 31,58%, а в исследуемой 55% \ 0 % \ 45%. У больных с ДППР мы также не отметили существенной, статистически значимой, динамики состояния полей зрения. В первые сроки наблюдения как в контрольной, так и в исследуемой группах отмечена тенденция к расширению полей зрения (преимущественно за счет уменьшения площади относительных скотом), а в последующие сроки – сужение периферических границ полей зрения. Указанные процессы напрямую коррелировали с показателями состояния стекловидного тела (рис. 2, 3) и ОГС (рис. 4, 5). В контрольной группе максимальная прозрачность стекловидного тела была зарегистрирована нами в сроки наблюдения 6-24 месяца, где она составила 0,78 балла. При этом улучшение оптических свойств отмечали в 84,21% оперированных глазах. К концу наблюдения этот показатель несколько возрос до 0,81 балла, однако, пропорции по признаку “лучше – без изменений - хуже” достоверно по сравнению с предыдущими сроками наблюдения не изменились, и составили 84,21% \ 10,53% \ 5,26%, соответственно. В исследуемой группе наилучшие показатели прозрачности отмечены нами в сроки от 12 до 36 месяцев наблюдений, где указанный показатель был равен 0,61 баллу. К концу срока наблюдений по качественному признаку распределение было следующим – 50% \ 45% \ 5%. Эти показатели, как в контрольной, так и в исследуемой группах напрямую связаны с остротой зрения и степенью выраженности ОГС. Максимальное снижение ОГС в контрольной группе отмечено к срокам наблюдения 12-36 месяцев, где он составил 0,69-0,71 балла (исходный – 2,63 балла), а в исследуемой группе - к 12 месяцу – 0,35 балла (исходный 2,5 балла). По качественному признаку распределение к концу наблюдения в контрольной группе было следующим: 89,47% \ 5,26% \ 5,26%; в исследуемой – 85% \ 15% \ 0%, при экспертной ранговой оценке в 0,75 балла. Изменение оптических свойств хрусталика и в контрольной, и в исследуемой группах отмечены нами только в последние три срока наблюдений, где они составили 1,39; 1,61; 1,79 баллов (исходное значение – 1,1 балл), в исследуемой – 1,25; 1,69; 1,86 балла (исходное значение – 1 балл).
Экспертная ранговая оценка картины глазного дна за время наблюдения, в обеих группах, имела тенденцию к некоторому нарастанию пролиферативных изменений. Исходное значение в обеих группах нами оценивалось в три балла, а к концу срока наблюдения: в контрольной – 4,11 балла, в исследуемой – 4,04 балла. Эти показатели находились в прямой зависимости с электрофизиологическими показателями. Электрочувствительность, как в контрольной, так и в исследуемой группе снижалась. К 3-12 месяцу от 119±62,23 мкВ до 113,64±54,87 мкВ – в контрольной группе и со 133,4±92,31 мкВ до 115,25±55,34 мкВ – в исследуемой. Электролабильность существенной динамики во все сроки наблюдения не имела. Показатели гидродинамики глаза в обеих группах также находились в пределах физиологических норм, однако, при ДППР оказалось более выраженное снижение Р0 в сроки наблюдения 1-6 месяцев. Снижение ВГД от исходных значений находилось в пределах от 2 до 3 мм рт. ст. К концу исследования уровень ВГД достиг исходного или на 1-1,5 мм рт. ст. превысил его.
Максимальное повышение зрительных функций у больных с диабетической пролиферативной ретинопатией, перенесших операцию реваскуляризацию хориоидеи (контрольная группа), отмечали в срок наблюдения 3-12 месяцев. При этом острота зрения повысилась с 0,04±0,01 до операции до 0,09±0,02 в срок наблюдения 6 месяцев (рис. 7).
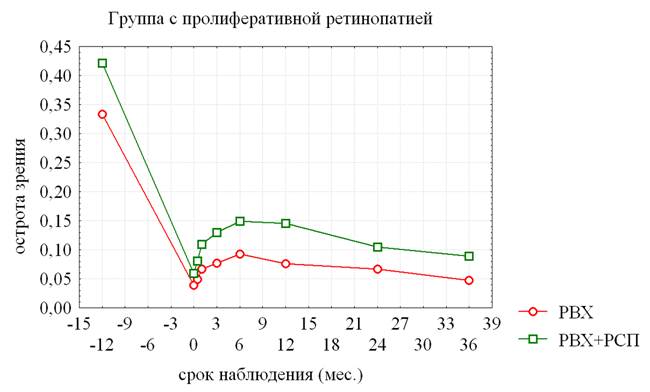
Рис. 7. Динамика остроты зрения у больных пролиферативной диабетической ретинопатией основной и контрольной групп до и после хирургического лечения
В относительных единицах этот показатель составил 225%. По признаку “лучше - без изменений - хуже” распределение больных было следующим: 81,82% \ 12,12% \ 6,06%. Максимальный подъем остроты зрения в основной группе (ДПР РВХ+РСП) отмечен нами в те же сроки наблюдения. Острота зрения с 0,06±0,017 увеличилась до 0,15±0,02 в сроки наблюдения 6 и 12 месяцев, что в относительных единицах составило 250%. Наилучшее распределение по признаку “лучше – без изменений - хуже” отмечалось в срок 6 месяцев: 81,64% \ 12,24% \ 6,12% , соответственно. Минимальная острота зрения в отдаленный период наблюдений и в контрольной, и в основной группах зарегистрирован в срок 3 года. Острота зрения в группе РВХ (контрольная) составила 0,06±0,02 (150% в условных единицах), а в основной 0,09±0,018 (150% в условных единицах). Распределение пациентов в контрольной и основной группах по качественному признаку “лучше – без изменений – хуже” было следующим: 45,45% \ 9,1% \ 45,45% и 38,77% \ 18,37% \ 42,86%, соответственно. На повышение зрительных функций незначительное влияние оказывала степень прозрачности хрусталика: в контрольной группе показатель прозрачности возрос с 1,33 балла (до операции) до 1,9 балла, а в основной с 1,39 балла до 1,88 балла. Повышение зрительных функций не сопровождалось статистически достоверными изменениями полей зрения. В первые сроки наблюдения (до 6 - 12 месяцев) в обеих группах имела место тенденция к расширению их за счет уменьшения площади относительных скотом. В более поздние сроки поля зрения несколько суживались в основном, за счет периферии. Улучшение зрительных функций контрольной и основной групп неизменно сопровождалось повышением прозрачности стекловидного тела (рис. 2, 3) и снижением степени выраженности ОГС (рис. 4, 5). В контрольной группе максимальная прозрачность стекловидного тела достигнута в срок наблюдения 3-6 месяцев, где этот показатель равнялся 1,03 – 1,0 балл. По качественному признаку в срок наблюдения 1 год распределение было следующим: 63,64% \ 27,27% \ 9,03%. В исследуемой группе минимальный показатель прозрачности стекловидного тела достигнут в срок наблюдения 12-36 месяцев, где он снизился с 2,22 балла (до операции) до 1 балла в срок наблюдения 24 месяца. В этот же срок наблюдения по качественному признаку “лучше – без изменений – хуже” распределение было следующим 71,43% \ 22,45% \ 6,12%. Минимальная выраженность ОГС была в контрольной группе в срок наблюдения 24 месяца – 0,49 балла, а в исследуемой - 0,52 балла в срок наблюдения 12 месяцев. Существенного значения операция не оказала на морфологические признаки состояния глазного дна при экспертной ранговой оценке. В контрольной группе этот показатель с 5,03 балла (до операции) возрос до 5,24 балла. В исследуемой группе повышение аналогичного показателя находилось в пределах 4,82 балла (до операции) - 5,14 балла в срок наблюдения 36 месяцев. Состояние зрительных функций и глазного дна отражалось также методами электрофизиологического исследования. Порог электрической чувствительности в контрольной группе изменился с 258,91± мкВ (до операции) до 432,69± мкВ в 36 месячный срок наблюдения. В исследуемой группе изменение порога электрочувствительности находилось в пределах 246,03± мкВ (до операции) – 408,38± мкВ в срок наблюдения 36 месяцев. Тенденция к повышению ПЭЧ имела место в обеих группах во все сроки наблюдения. Существенных сдвигов показателей электролабильности не отмечено. В контрольной группе до операции он был равен 36,03± Гц, после операции 28,26± Гц (срок наблюдения 36 месяцев). В исследуемой группе до операции 33,24± Гц. В 36 месячный срок наблюдения – 26,07± Гц. Внутриглазное давление существенно не менялось и находилось в рамках физиологической нормы: контрольная группа – 15,36±2,8 мм рт. ст., до операции; минимальное значение 13,36±2,83 мм рт. ст. – в срок наблюдения 1 месяц. В исследуемой группе: 14,99±2,54 мм рт. ст. (до операции) – 12,84±2,96 мм рт. ст. Показатели продукции и оттока внутриглазной жидкости также находились в пределах физиологических значений.
Анализируя результаты хирургического лечения у больных с диабетической ретинопатией можно отметить, что операции реваскуляризирующего типа являются малотравматичными вмешательствами, не приводящими к выраженной воспалительной реакции, и способствуют быстрому рассасыванию кровоизлияний с минимальными следовыми изменениями со стороны стекловидного тела и оболочек глазного яблока. Используемая нами техника операции выполнима в условиях обычного микрохирургического стационара без применения специального дорогостоящего оборудования, квалифицированным врачебным персоналом. Мы не отметили каких-либо серьезных осложнений ни в процессе операции, ни в послеоперационном периоде, которые могли бы привести к снижению и потере зрительных функций. Это отличие является существенным, если сравнивать предлагаемую нами хирургическую операцию с операцией по удалению патологически измененного стекловидного тела – витреоэктомией. Как известно, витрэктомия является полостной операцией и количество интра- и послеоперационных осложнений достигает 25-50%. Причем, эти осложнения нередко носят ятрогенный характер (разрыв сетчатки, повреждение сосудов сетчатки и хориоидеи).
Нами отмечено, что при всех стадиях заболевания и во всех группах (контрольной и исследуемой) имеет место статистически значимое повышение зрительных функций. Максимальная острота зрения была получена в сроки наблюдения 6 - 12 месяцев и превышала дооперационную в 2-3 раза. Однако, обращает на себя внимание тот факт, что оценивая результаты операций в относительных единицах, более существенное повышение остроты зрения наблюдали в исследуемых группах при всех стадиях заболевания. Более предпочтительно оказывалось и распределение оперированных глаз по качественному показателю. Процесс возрастания остроты зрения и в контрольной, и в исследуемой группе непременно сопровождался повышением прозрачности стекловидного тела за счет снижения степени выраженности отечно-геморрагических проявлений. Более значимое снижение ОГС мы всегда отмечали в группах с сочетанным применением реваскуляризирующих операций (в абсолютных, в относительных единицах и по качественному составу). Практически не оказывал влияния на остроту зрения показатель прозрачности хрусталика, который все же имел незначительную тенденцию к снижению прозрачности. Его изменения не носили достоверного характера и явились следствием естественных биологических процессов, обусловленных продолжительным сроком наблюдения. Мы также не отметили положительного или отрицательного влияния операций на морфологические изменения глазного дна. Те органические изменения, произошедшие к моменту операции, у большинства больных существенно не изменялись. Этот факт мы считаем также положительным результатом наших операций, так как они способствовали стабилизации диабетического процесса на глазном дне. Нашу офтальмоскопическую оценку подтверждают данные электрофизиологического исследования. Ни в одной группе не отмечено отрицательной динамики показателя электролабильности. Повышение порогов электрической чувствительности вполне объяснимо, если учесть, что основное заболевание – сахарный диабет продолжал оказывать свое влияние, а как известно, волокна зрительного нерва весьма чувствительны к гипоксическим состояниям. Этот факт подтверждает и повышение общей светочувствительности (более выражено в исследуемой группе) в макулярной и парамакулярной зонах, ибо дифференцирует более качественную работу центральных отделов сетчатки при повышении порогов электрической чувствительности. Некоторое снижение показателей гидродинамики вполне объяснимо, если учесть, что практически все оперированные пациенты имели в большей или меньшей степени внутриглазные кровоизлияния. Активное рассасывание этих кровоизлияний, достигнутое применением реваскуляризирующих операций, оказывает тормозящее действие на функцию цилиарного тела, так как большинство пациентов было оперировано с давностью кровоизлияния 3 месяца и более. Гемолиз эритроцитов и освобождение свободных радикалов ионов железа, возможно оказывает негативное воздействие при их утилизации на функциональное состояние цилиарного тела, выражающееся в угнетении продукции внутриглазной жидкости, а вслед за этим снижением Р0 и коэффициента легкости оттока. Указанный процесс имел место как в контрольной, так в исследуемой группах.
Сопоставляя полученные результаты с данными литературы по применению лазеркоагуляции, криокоагуляции, виртеоэктомии можно отметить, что сочетанные реваскуляризирующие операции были применены нами у пациентов, которые прошли это лечение ранее и не получили положительного результата. У значительной части больных, практически всех групп во все стадии заболевания в различные сроки до операции, была проведена лазеркоагуляция, которая не предотвратила внутриглазные кровоизлияния различной интенсивности и не способствовала повышению зрительных функций. Анализируя и сопоставляя результаты витрэктомии, следует отметить, что в случаях с отсутствием выраженной отслойки сетчатки показатели эффективности витрэктомии и сочетанного применения реваскуляризирующих операций приближены. Однако, более низкая себестоимость реваскуляризирующих операций, значительно меньшая их тяжесть и продолжительность операций позволяют предложить данное вмешательство как альтернативу витрэктомии в большинстве случаев. Вместе с тем, у больных диабетической ретинопатией, осложненной витреоретинальной тракцией, органическими изменениями стекловидного тела, несомненно, должна быть применена операция витрэктомия. Кроме того, предложенный нами метод хирургического лечения не исключает применения витрэктомии и, по нашему мнению, не усложняет ее выполнение, не снижает ее результатов, если в течение 1-3 месяцев после проведения реваскуляризирующих сочетанных операций не наблюдается положительной динамики зрительных функций.
Результаты применения криокоагуляции приближены к результатам операций реваскуляризирующего типа. Однако, как указывают многие авторы, дозировать холодовое воздействие на оболочки глаза из-за нарушения прозрачности оптических сред практически невозможно. Передозировка холодового воздействия при отсутствии визуального контроля приведет к грубым нарушениям проницаемости гематоофтальмического барьера, воспалению сосудистой оболочки глаза и спровоцирует пролиферацию рубцовой ткани в стекловидном теле.
Таким образом, сочетанная реваскуляризирующая операция (реваскуляризация хориоидеи и лечебное ретросклеропломбирование) с применением биологического материала Аллоплант является малотравматичным, эффективным хирургическим вмешательством при диабетической ретинопатии и может быть применена на этапах медико-социальной реабилитации.
Заключение
Сочетанная реваскуляризирующая операция с применением биоматериала Аллоплант является эффективным способом хирургического лечения больных с диабетической ретинопатией.
В эксперименте сочетанная реваскуляризирующая операция с применением биоматериала Аллоплант ускоряет рассасывание внутриглазного кровоизлияния без образования помутнений стекловидного тела, способствует восстановлению ультраструктуры клеток сетчатки - пигментного эпителия, фоторецепторов, восстановлению морфо-функциональных связей между клетками сетчатки. Сочетанная реваскуляризирующая операция с применением биоматериала «Аллоплант» повышает и стабилизирует зрительные функции и функциональные показатели зрительного анализатора при непролиферативной и препролиферативной стадии заболевания у 84 - 93% оперированных больных.
Сочетанная реваскуляризирующая операция с применением биоматериала «Аллоплант» повышает и стабилизирует зрительные функции и функциональные показатели зрительного анализатора при пролиферативной стадии заболевания у 47,3% оперированных больных.
Сочетанная реваскуляризирующая операция не оказывает существенного влияния на офтальмотонус, показатели продукции и оттока камерной влаги, но ускоряет венозный отток, стабилизирует проницаемость микрососудов у пациентов с диабетической ретинопатией.
Сочетанная реваскуляризирующая операция у пациентов с диабетической ретинопатией не оказывает существенного влияния нанейрофизиологические показатели (электрочувствительность, электролабильность, величину «a»- и «b»-волн), но существенно повышает общую светочувствительность зрительного анализатора.
Показаниями к сочетанной реваскуляризирующей операции с применением биоматериала Аллоплант при диабетической ретинопатии являются отек сетчатки, свежие и неорганизовавшиеся внутриглазные кровоизлияния. Относительным противопоказанием к операции является организация кровоизлияния с переходом в фиброз, повышенное внутриглазное давление, сахарный диабет в стадии декомпенсации.
Практические рекомендации
Сочетанная реваскуляризирующая операция применима для лечения больных с диабетической ретинопатией, не требует специального дорогостоящего оборудования и может выполняться в условиях обычного офтальмологического стационара. Отсутствие серъезных интра- и послеоперационных осложнений позволяет поставить эту операцию как альтернативу витрэктомии при отечно-геморрагических формах диабетической ретинопатии.
Литература
1. Реваскуляризирующая хирургия диабетической ретинопатии//1 Евро-Азиатская конференция по офтальмохирургии: Материалы.- Екатеринбург, 1998.- С. 85. (Соавт.: Мулдашев Э.Р., Родионов О.В., Султанов Р.З.).
2. Состояние центрального поля зрения у больных с диабетической ретинопатией//1 Евро-Азиатская конференция по офтальмохирургии: Материалы. - Екатеринбург, 1998.- С. 86-87. (Соавт.: Родионов О.В., Мухамадеев Р.А., Султанов Р.З.).
3. Диспергированный биоматериал “Аллоплант” в лечении диабетической ретинопатии//I Евро-Азиатская конференция по офтальмохирургии: Материалы. – Екатеринбург, 1998. – С. 87-88. (Соавт.: Родионов О.В., Султанов Р.З., Ларин А.И.)
4. Экспериментально-морфологические и клинические аспекты механизма операции реваскуляризации хориоидеи//Двенадцатая научно - практическая конференция офтальмологов Красноярского края. - Красноярск,1998.- С. 147-148. (Соавт.: Мулдашев Э.Р., Родионов О.В., Муслимов С.А., Султанов Р.З., Мустафин М.М.).
5. Гемогидродинамика после реваскуляризирующих операций у больных с диабетической ретинопатией//Двенадцатая научно-практическая конференция офтальмологов Красноярского края, Красноярск, 1998.- С.270-271. (Соавт.: Родионов О.В., .Мустафин М.M, Султанов Р.З. )
6. Ультразвуковая биомикроскопия анастомоза «хориоидея-эписклера» после реваскуляризирующих операций больных с диабетической ретинопатией//Диабет глаза: Материалы научно-практической конференции офтальмологов.- Оренбург, 1999.- С.31-32. (Соавт.: Мулдашев Э.Р., Родионов О.В., Тахчиди Х.П., Иванов Д.И.)
7. Отдаленные визуальные результаты реваскуляризирующих операций у больных с диабетической ретинопатией//Диабет глаза: Материалы научно-практической конференции офтальмологов. - Оренбург, 1999.- С.32-33. (Соавт.: Мулдашев Э.Р., Родионов О.В., Султанов Р.З., Булатов Р.Т.).
8. Хирургическое лечение ятрогенной субатрофии глазного яблока у больных с сахарным диабетом//Диабет глаза: Материалы научно-практической конференции офтальмологов. - Оренбург, 1999.- С.33-34. (Соавт.: Мулдашев Э.Р., Родионов О.В., Султанов Р.З., Булатов Р.Т.).
Технические условия
«Аллотрансплантанты для офтальмохирургии» ТУ 42-2-537-2006.
к содержанию | опубликовать статью
ОПТИМИЗАЦИЯ ПАТОФИЗИОЛОГИЧЕСКИХ МЕХАНИЗМОВ РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ РОГОВИЦЫ ЛОКАЛЬНЫМ И АКУПУНКТУРНЫМ ВВЕДЕНИЕМ АЛЛОГЕННОГО ДИСПЕРГИРОВАННОГО БИОМАТЕРИАЛА
Мулдашев Э.Р., Галияхметов Р. Ф.
Работа выполнена в ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию» и ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Автором разработан метод акупунктурного и локального (перилимбального) введения биоматериалов Аллоплант, который использован для стимуляции репаративной регенерации эпителия и соединительнотканных структур роговицы при ее экспериментальном ожоге. Инъекционная форма биоматериалов Аллоплант, длительно поддерживая локальные сосудистые и клеточные реакции, может использоваться в схеме фармакопунктурной терапии с учетом ее пролонгированного эффекта и последующей полной резорбции трансплантата без явлений фиброза в области инъекции.
Актуальность исследования
Одним из приоритетных направлений современной теоретической и клинической медицины является трансплантация тканей. Аллогенные трансплантаты на основе твердой мозговой оболочки, перикарда, фасций, дермы, сухожилий заняли прочное место в повседневной практике пластической и челюстно-лицевой хирургии, травматологии, неврологии, стоматологии, офтальмохирургии и других областях медицины (Савельев В.И., 2000; Полянская Н.К., 2007; Милюдин Е.С., 2007; Стадников А.А., 2009; Мулдашев Э.Р., 1976-2009).
Современные технологии позволяют модифицировать структуру трансплантатов, получая при этом биоматериалы с различным биохимическим составом, фиброархитектоникой и биомеханическими свойствами (Хасанов Р.А., 1999; Мулдашев Э.Р., 2009; Муслимов С.А., 2009;). В многопрофильном тканевом банке Всероссийского центра глазной и пластической хирургии в ряду производимых здесь 96 видами биоматериалов важное место занимают диспергированные формы (Хасанов Р.А., 1999). Данные биоматериалы нашли наиболее широкое применение в тех случаях, когда целью аллотрансплантации является достижение не только локального ответа, но и системной реакции организма.
Опираясь на опыт отечественной медицины в области трансплантации тканей, а также технологии традиционной медицины (фармакопунктуру (Путилина Н.Е., 2001; Агасаров П.Г., 2002; Болдин А.В., 2005), электропунктуру (Zhou H.-L. et al., 2008; Almeida R.T. et al., 2008; Guo J. et al., 2008), лазеропунктуру (Pohodenko-Chudakova I. et al., 2006) и другие, нами предпринята попытка интеграции указанных концептуальных подходов. При планировании данной работы мы также учитывали опыт собственной клиники. В частности, принципиальная возможность и высокая терапевтическая эффективность акупунктурного введения инъекционных форм биоматериала Аллоплант защищена патентом (№ 2238076 от 12.05.2003г. «Способ лечения и профилактики заболеваний воздействием на биологически активные точки и зоны» Э.Р. Мулдашев с соавт.). Основу настоящей работы составили результаты экспериментально-морфологических исследований. На фоне стандартной экспериментальной модели ожога роговицы проводилась терапия методом локальной субконъюнктивальной тканевой трансплантации, а также введения диспергированного биоматериала в параорбитальные акупунктурные точки.
Исследовав при этом процессы репаративной регенерации роговицы, можно судить об эффекте фармакопунктуры с использованием аллогенных трансплантатов.
Учитывая изложенное, нами сформулирована следующая цель исследования: на основе гисто- и патофизиологических исследований доказать эффективность коррекции повреждений роговицы локальным и акупунктурным введением диспергированного биоматериала Аллоплант.
Материалы и методы исследования
Методы изучения реактивных процессов в биоактивных точках при введении ДБА и при классической иглорефлексотерапии
Настоящая серия опытов предпринята с целью обосновать введение ДБА в точку акупунктуры (ТА). Для этого проведен сравнительный анализ клеточных и сосудистых реакций в ТА при введении ДБА и при классической иглорефлексотерапии, выбранной в качестве контроля.
Опыты проведены на 22 кроликах породы Шиншилла. ТА определялись с помощью аппарата «AcuVision-04», представляющего собой высоковольтный импульсный генератор с микропроцессорным управлением. Для визуализации акупунктурных точек необходимо использовать диэлектрик. Над ТА на диэлектрике возникает «пробой» и формируется феномен люминесценции в виде яркого пятна.
ТА выявлялись в параорбитальной области. В опытной серии в указанные точки под кетаминовым наркозом производилась инъекция ДБА, производимы тканевым банком Всероссийского центра глазной и пластической хирургии в соответствии с требованиями ТУ 42-2-537-2006. Навеска в одном флаконе составляет 200 мг. Указанное количество разбавляется 5 мл физиологического раствора NaCl. Животные выводились из опыта путем воздушной эмболии на 3, 7, 14, и 30 сутки эксперимента.
В контрольной серии в аналогичных условиях производилась иглорефлексотерапия. Десяти животным визуализировались ТА по задней срединной линии и в параорбитальной области (те же, что и в предыдущей серии опытов) с помощью прибора «AcuVision-04», после чего первому животному производили введение акупунктурной иглы D=0,46 мм с экспозицией 10 минут (среднее раздражение по Д.М. Табеевой, 2004) в одну ТА. Следующему животному также 2 сеанса иглорефлексотерапии с интервалом 24 часа. Последнему – десятому кролику было выполнено соответственно 10 манипуляций с интервалом 24 часа. Животные выводились на 14-е сутки с момента последней манипуляции путем воздушной эмболии. Предварительные исследования, проведенные в отделе морфологии ФГУ «ВЦГПХ Росздрава» (зав. отделом Муслимов С.А.) показали, что именно на 14-е сутки в коже кролика завершается «острая» сосудистая реакция на травму (инъекция, иглоукалывание и т.п.).
Кожа и субдермальная рыхлая волокнистая соединительная ткань области инъекции забирались с помощью трепана диаметром 7 мм. Материал фиксировался в 10% нейтральном формалине, и после обезвоживания заливался в парафин. Срезы толщиной 7 мкм окрашивались гематоксилином и эозином. Препараты исследовались в поляризационном микроскопе МИН-8 с использованием объективов 40х, 60х и окуляра 10х. Микрофотографирование производилось на пленку «Фуджиколор» - 400 в аппарате МФН-10 с использованием гомали 3.0. Для морфометрии использовался микрометр окулярный винтовой типа МОВ-15.0.
Реактивные процессы в двух сериях сравнивались по морфометрическим параметрам. Для этого на гистологических препаратах производился подсчет суммарной площади просвета капилляров (СППК) на 22,5 тыс. мкм2. Также определялась плотность макрофагальной инфильтрации на 10 тыс. мкм2. Для изучения динамики резорбции биоматериала использовался метод количественной оценки коэффициента анизотропии (КА) коллагеновых структур. При этом использовалась функция «сегментация» программы Biovision 3.0.
Также использована методика определения TGFβ-1 в контактной зоне сетчатого слоя дермы. С помощью программы Biovision 3.0 производилось измерение площади прокрашенных МКАТ (фирма Santa Cruz Biotechnology Inc., 1999) участков препарата. Проведенный анализ позволил вывести относительный показатель содержания TGFβ-1 в контактной зоне сетчатого слоя дермы, выражающийся в процентах.
Методы исследования реактивных процессов в роговице после экспериментального ожога на фоне локального и акупунктурного введения ДБА
Данные опыты проведены с целью сравнительного анализа динамики репаративной регенерации роговицы при её ожоге с последующим локальным или акупунктурным введением ДБА.
Экспериментальные исследования выполнены на 27 кроликах породы Шиншилла. Ожог диаметром 6 мм в центре роговицы вызывался 2,5% раствором едкого натра. Экспозиция 30 секунд по А.Э. Бабушкину и Г.Г. Хафизову (1996). 3 группы экспериментов. В первой группе после нанесения ожога лечебных мероприятий не проводилось, и данные животные служили контролем. В следующей группе после нанесения ожога производилась субконъюнктивальная инъекция ДБА (1 мл). Раствор ДБА готовился путем разведения 200 мг биоматериала в 5 мл физиологического раствора NaCl. В третьей группе идентифицировались параорбитальные ТА цин-мин BI1 (V-1), тун-цзы-ляо GB1 (VB1), куда производилась инъекция раствора ДБА в количестве 0,5 мл в каждую точку. Животные выводились из опыта на 7, 14, 30-е сутки. Для гистологического исследования забиралась роговица вместе с прилежащей частью склеры, а также кожа и субдермальные ткани в области акупунктурного введения ДБА.
Ткани консервировались в 10% нейтральном формалине. Затем готовились гистологические срезы толщиной 7 мкм, которые окрашивались гематоксилином и эозином, по Маллори, а также по Ван-Гизону. Полученные препараты изучались в поляризационном микроскопе «МИН-8». Наши исследования показали, что наиболее адекватным методом для сравнительного изучения поляризационно-оптических свойств роговицы, является окраска по Маллори в прописи Д.С. Саркисова (2000).
Для данных исследований использованы гистологические срезы роговицы в сагиттальной и горизонтальной плоскостях. С помощью предварительно откалиброванной на объектив ×20 программы Biovision 3.0 производилось измерение площади оптически активных объектов препарата с помощью специальной функции программы – «сегментация», при заданном диапазоне яркости: 170÷250.
Для изучения динамики реактивных процессов производился подсчет СППК области лимба с использованием программы Biovision 3.0.
В трех сериях опытов проводились иммуногистохимические исследования с использованием моноклональных антител (МКАТ) к TGFβ-1 и к PCNA – ядерный антиген пролиферирующих клеток (фирма Santa Cruz Biotechnology Inc., 1999). PCNA определялся в клетках эпителия роговицы, а TGFβ-1 в собственном веществе. Оценка результатов производилась с помощью функции «подсчет части» программы Biovision 3.0. В результате получено два относительных показателя содержания приведенных маркеров в роговице.
Методы статистической обработки
В нашей работе исследовались количественные показатели: суммарная площадь просвета капилляров, относительные показатели содержания цитокинов и маркеров, коэффициент анизотропии.
В исследуемых нами показателях среднее значение и среднее квадратическое отклонение заранее не были известны, а их расчет с помощью пакета программ Microsoft Office является трудоемким. Исходя из этого анализ соответствия вида распределения признака закону нормального распределения производился методами Лиллиефорса и Шапиро-Уилка W в программе Statistica 5.5 модуле «основные статистики и таблицы» промодуле «таблицы частот». Уровень статистической значимости для рассматриваемых количественных показателей, рассчитанный приведенными методами всегда был больше 0,05, а в некоторых случаях больше 0,1, следовательно, распределение исследуемых признаков приближено к нормальному.
Для описания выборочного нормального распределения исследуемых признаков (размеры железы и др.) использовались следующие параметры программы Statistica 5.5 модуля «основные статистики и таблицы» промодуля «описательные статистики»: - число наблюдений (всегда ≥ 100); - среднее значение признака; - стандартная ошибка (m) - доверительный интервал (ДИ). Соответственно на полученных графиках отражались только три последних параметра (M±ДИ, ±m).
Для сравнения полученных результатов в различных сериях опытов использовался параметрический метод (t-критерий Стьюдента для независимых групп). Учитывая, что средние значения признаков и средние квадратические отклонения были заранее известны, проверка нулевой статистической гипотезы выполнялась процедурой «различия между двумя средними (нормальное распределение)»промодуль «другие критерии значимости»модуль «основные статистики и таблицы»Statistica 5.5 В случае если p>0,05 различия признавались статистически незначимыми, и принималась нулевая гипотеза об отсутствии различий. Альтернативная гипотеза принималась при р<0,05, такие различия считались статистически значимыми.
Результаты исследования и их обсуждение
В настоящей работе проводится сравнительный анализ трансплантации тканей, как современного направления европейской медицины, и фармакопунктуры, как направления традиционной медицины с целью определения возможностей их использования в восстановительной медицине. На первом этапе определялась возможность фармакопунктуры биоматериалом Аллоплант. В качестве контроля выбрана методика классической иглорефлексотерапии.
Реактивные изменения в коже при классической иглорефлексотерапии и акупунктуре ДБА
Исследования сетчатого слоя дермы на фоне акупунктурного введения ДБА отражают положительную динамику репаративных процессов. Показатель, отражающий содержание TGFβ-1 в сетчатом слое дермы в 1,49 раза (p<0,05) превышает нормальные значения на 3-и сутки эксперимента. Начиная с 7-х суток, экспрессия TGFβ-1 в постепенно снижается и нормализуется на 30-е сутки (Рис. 1). Полученные данные согласуются с A.B. Roberts et al. (1990) и J. Halper et al. (2005), которые показали ангиогенное действие нормальных титров TGFβ-1. В контроле на фоне иглорефлексотерапии на 14-е сутки наблюдается увеличение экспрессии TGFβ-1 в сетчатом слое дермы кратное числу сеансов процедуры. При минимальном числе сеансов иглорефлексотерапии выбранный показатель в 1,48 раз выше (p<0,05) нормы, при 4-7 сеансах – в 1,84 раза (p<0,05), а при 8- 10 сеансах – в 2,64 раза (p<0,01) превышает нормальные значения (рис. 1).
Рис. 1. Относительный показатель содержания TGFβ-1 в сетчатом слое дермы кролика в норме, при иглорефлексотерпии и на фоне акупунктурного введения ДБА. Ось абсцисс: показатель, %. Ось ординат: сроки эксперимента
Известно, что TGFβ-1 является фиброгенным агентом (Sporn M.B., Roberts A.B., 1990). Результаты выполненных исследований соответствуют данным Е.Б. Новикова с соавт. (2004), которые также указывают на формирование локального рубца в коже в области многократно проводимой акупунктуры.
В области акупунктурного введения ДБА в сетчатом слое дермы на 14-е сутки наблюдается увеличение СППК в 3,4 раза (p<0,01). Тогда как результаты контрольной серии позволили выявить зависимость между числом сеансов иглоукалывания и кратностью снижения СППК в сетчатом слое дермы на 14-е сутки эксперимента. Так, при 1-3 сеансах иглорефлексотерапии СППК варьирует в пределах нормы (p>0,05), при 4-7 сеансах – снижается в 1,4 раза (p<0,05), а при максимальном числе сеансов (8-10) наблюдается двукратное снижение (p<0,05) выбранного показателя. При этом в опытной серии в отдаленные сроки происходит сохранение высоких значений СППК: 133% (p<0,05) от нормы (Рис. 2).
Рис. 2. Суммарная площадь просвета капилляров в сетчатом слое дермы в норме, при сеансах иглорефлексотерпии и на фоне акупунктурного введения ДБА Ось абсцисс: СППК в контактной зоне, мкм2. Ось ординат: сроки эксперимента
Данный факт свидетельствует о перестройке микроциркуляторного русла и о процессах неоангиогенеза в области введения биоматериала. Полученные нами результаты подтверждают данные В.В. Серова (1995) о важной роли адекватного кровоснабжения тканевого ложа в резорбции биоматериала макрофагами и в регенерации тканей.
В исследованные сроки в опытной серии сохраняется высокая плотность макрофагальной инфильтрации в трансплантате и тканевом ложе, что можно рассматривать как структурный эквивалент высокой биологической активности акупунктурной точки при введении ДБА. Считается доказанным, что клеточная реакция на биоматериал зависит от его химической природы (Лаврищева Г.И., Оноприенко Г.А., 1996). Следует также отметить, что введение ДБА активирует миосателлитоциты, что согласуется с результатами работы А.А. Стадникова с соавт. (2001).
Сравнительный анализ результатов двух указанных серий экспериментов позволил сформулировать следующее заключение. Введение ДБА в ТА мобилизует целый комплекс сосудистых и клеточных реакций, которые проявляются в полиморфной инфильтрации с участием макрофагов и процессами ангиогенеза с последующей резорбцией волокнистого матрикса биоматериала.
Научная новизна проведенных исследований защищена патентом РФ (№ 2238076 от 12.05.2003г. «Способ лечения и профилактики заболеваний воздействием на биологически активные точки и зоны» Э.Р. Мулдашев с соавт.).
Полученные факты позволили спланировать серию экспериментов по акупунктурному введению ДБА в параорбитальные точки на фоне химического ожога роговицы.
Реактивные процессы в роговице после ожога на фоне локального и акупунктурного введения ДБА
Независимо от серии экспериментов унифицированная ожоговая травма приводит к деструкции эпителия, базальной мембраны и поверхностных слоев собственного вещества роговицы. Глубина ожоговой травмы достигает 50 мкм. На границе с указанной зоной также происходят выраженные деструктивные процессы, что позволило определить нам выбранную область как зону контакта с детергентом (200 мкм). Отражением указанных процессов в строме роговицы является снижение коэффициента анизотропии (КА) до 20% от нормы на 3-и сутки (p<0,01). По периферии от контактной зоны выявляются реактивные процессы в виде пролиферации кератобластов, макрофагов, лейкоцитов. Приведенную область мы определяем как реактивную зону (до 500 мкм от контактной зоны). В периферической зоне роговицы на светооптическом уровне изменения не определяются. Выделенные нами гистотопографические зоны при ожоговой травме роговицы в целом соответствуют таковым на фоне экспериментальной механической травмы (Максимов И.Б., 1990). Выраженность указанных зон и динамика репаративных процессов зависит от серии экспериментов.
В эксперименте по химическому ожогу роговицы в ранние сроки наблюдается восстановление поврежденных структур роговицы. Передний эпителий восстанавливается с неодинаковой скоростью в разных сериях опытов. Так, в серии с акупунктурным введением ДБА эпителий характерный для нормальной роговицы обнаруживается лишь на 14-е сутки эксперимента. При этом уровень PCNA в ядрах клеток переднего эпителия нормализуется уже на 7-е сутки. Перилимбальное введение ДБА запускает механизмы, приводящие к более раннему восстановлению структуры переднего эпителия. Уже на 7-е сутки в гистологических препаратах обнаруживается 3-4-слойный эпителий.
Рис. 3. Относительный показатель содержания PCNA в собственном веществе роговицы кролика в норме, после ожоговой травмы, на фоне локального (опыт 1) и акупунктурного (опыт 2) введения ДБА. Ось абсцисс: показатель, %. Ось ординат: сроки эксперимента
Однако уровень PCNA в данной серии нормализуется также на 7-е сутки эксперимента (Рис. 3). Уровень PCNA – ядерного антигена пролиферирующих клеток является адекватным показателем пролиферации эпителиоцитов переднего эпителия роговицы (Yew D.T. et al., 2000).
Патоморфологические изменения в собственном веществе роговицы в серии с акупунктурным введением ДБА имеют схожую с контролем динамику. Однако в опытной серии наблюдается менее выраженный отек собственного вещества роговицы. Также как и в контрольной серии, на 3-е сутки происходит вовлечение средних и глубоких слоев собственного вещества роговицы в воспалительный процесс. К 7-м суткам коллагеновые волокна средних и глубоких слоев собственного вещества роговицы имеют одноосную ориентацию. В поверхностных слоях собственного вещества наблюдается снижение оптической активности. Так, на 7-е сутки КА собственного вещества роговицы восстанавливается лишь на 63% (p<0,05). В контрольной серии схожий эффект достигается лишь на 14-е сутки (72,3%, p>0,05) . При перилимбальном введение ДБА восстановление оптических свойств роговицы происходит на 7-е сутки после ожога. Так, коэффициент анизотропии на 7-е сутки составляет 94% (p<0,05) от нормы (Рис. 4). Данный факт объясняется тем, что на ранних этапах репарации не происходит вовлечения в патологический процесс средних и глубоких слоев собственного вещества роговицы. Известно, что высокая оптическая активность определяет морфологическую и функциональную зрелость коллагеновых структур (Павлова В.Н. с соавт., 1998).
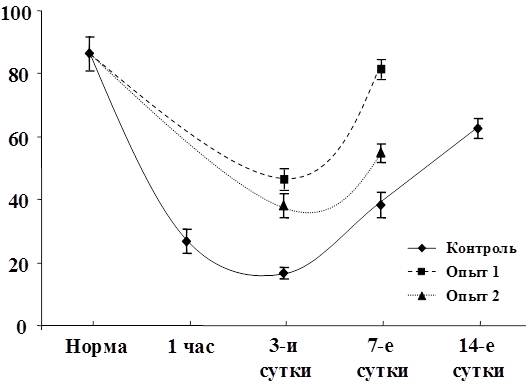
Рис. 4. Коэффициент анизотропии собственного вещества роговицы кролика в норме, после ожоговой травмы, на фоне локального (опыт 1) и акупунктурного (опыт 2) введения ДБА. Ось абсцисс: показатель, %. Ось ординат: сроки эксперимента
Перилимбальное и акупунктурное введение ДБА приводят к незначительному увеличению уровня TGFβ-1 в собственном веществе роговицы в ранние сроки. При этом TGFβ-1 обнаруживается в основном в цитоплазме фибробластов различной степени дифференцировки и клеток моноцитарно-макрофагальной системы. На 7-е сутки независимо от способа введения ДБА происходит нормализация содержания TGFβ-1 в ткани роговицы. Через систему макрофагов ДБА влияет на пролиферативную и синтетическую активность фибробластов. В контрольной серии наблюдается нарастание титра выбранного цитокина (Рис. 5), что определяет тенденцию к образованию бельма на роговице (Lee J. et al., 2008). Так, относительный показатель, отражающий содержание TGFβ-1 на 7-е сутки более чем в 15 раз, превышает нормальные значения (p<0,001).
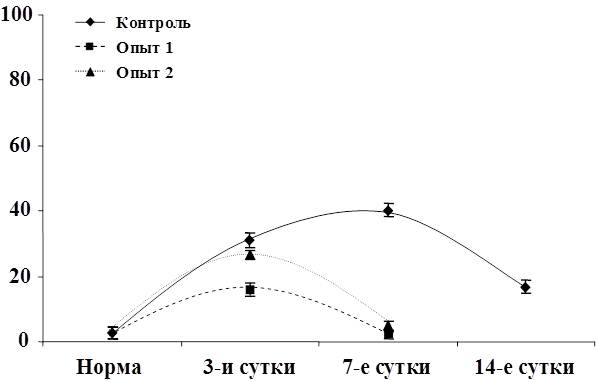
Рис. 5. Относительный показатель содержания TGFβ-1 в собственном веществе роговицы кролика в норме, после ожоговой травмы, на фоне локального (опыт 1) и акупунктурного (опыт 2) введения ДБА. Ось абсцисс: показатель, %. Ось ординат: сроки эксперимента
Известно, что уровень кровоснабжения области лимба во многом определяет исходы регенерации роговицы (Majo F. et al., 2006). Так, в контрольной серии наблюдается выраженная сосудистая реакция в области лимба, проявляющаяся в увеличении СППК уже через час после ожога роговицы. Пик роста выбранного показателя приходится на 7-е сутки, когда суммарный просвет капилляров в 2,5 раза (p<0,05) превышает норму. Высокий уровень СППК обусловлен при этом не только дилатацией сосудов краевой петлистой сети, но и включением в кровоток покоившихся в норме сосудистых терминалей. При локальном введении ДБА наблюдается полиморфно-клеточная инфильтрация и расширение всех элементов микроциркуляторного русла: СППК на 3-и сутки возрастает в 2,1 раза (p<0,05) в сравнении с нормой. По данным Гундоровой Р.А. с соавт., 2005 продукты химической деструкции клеток и коллагена вызывают выраженную вазомоторную реакцию сосудов краевой петлистой сети в ранние сроки. Сосудистые изменения в области лимба при акупунктурном введении выражаются в подъеме уровня СППК в 2,5 раза (p<0,05) на 3-и сутки, что на 20% выше (p>0,05), чем в серии с перилимбальным введением ДБА. На 7-е сутки происходит увеличение в опытных сериях наблюдается пик увеличения СППК: до 279% (p<0,05) от нормы на фоне перилимбального введения ДБА (за счет неоангиогенеза) и до 321% (p<0,05) от нормы на фоне акупунктурного введения ДБА (рефлекторный механизмом действия акупунктуры на сосуды краевой петлистой сети) [Рис. 3].
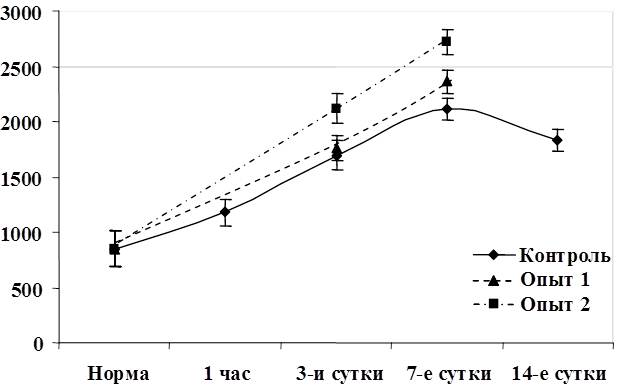
Рис. 6. Суммарная площадь просвета капилляров в области лимба у кролика в норме, после ожоговой травмы, на фоне локального (опыт 1) и акупунктурного (опыт 2) введения ДБА. Ось абсцисс: показатель, %. Ось ординат: сроки эксперимента.
Проведенные нами клинические испытания представляемой технологии Аллоплант полностью подтвердили высокую эффективность локального введения ДБА и фармакопунктуры при лечении травматических поражений роговицы и склеры.
Метод фармакопунктуры с использованием биоматериалов Аллоплант также продемонстрировал положительные результаты при лечении последствий травм, соединительнотканных дисплазий, других видах патологии органа зрения.
Заключение
Как локальное, так и акупунктурное введение диспергированного биоматериала Аллоплант являются эффективными методами стимуляции репаративных процессов в соединительнотканных и эпителиальных структурах, что показано на модели регенерации роговицы. Доказана эффективность применения диспергированного биоматериала Аллоплант при локальном и акупунктурном введении, что подтверждено патентом №2238076 (12.05.2003г.) «Способ лечения и профилактики заболеваний воздействием на биологически активные точки и зоны».
Акупунктурное введение ДБА приводит к комплексу сосудистых и клеточных реакций, не сопровождающихся фиброзом в области инъекции. При этом СППК в зоне акупунктуры превышает нормальные значения СППК на уровне сетчатого слоя дермы в 1,33 раза. Уровень TGFβ-1, отражающий пролиферацию соединительной ткани, незначительно увеличивается при введении ДБА и к 30-м суткам эксперимента полностью нормализуется.
Курс классической иглорефлексотерапии приводит к выраженным локальным сосудистым и клеточным реакциям с формированием в области микротравмы грубоволокнистой соединительной ткани, что подтверждается повышением уровня TGFβ-1 (в 2,64 раза выще нормы), а также низкой плотностью микроциркуляторного русла (двукратное уменьшение СППК).
Экспериментальное моделирование химического ожога роговицы приводит к некрозу тканей в контактной зоне с последующим развитием воспалительных процессов. Нарушение анатомической структуры собственного вещества роговицы проявляется снижением коэффициента анизотропии до 44% от нормы на седьмые сутки. Нормализация переднего эпителия в контроле происходит на 14-е сутки эксперимента при том, что уровень PCNA в ядрах эпителиоцитов восстанавливается на седьмые сутки.
Перилимбальное введение ДБА оптимизирует репаративные процессы, которые проявляются нормализацией поляризационно-оптических свойств собственного вещества роговицы в ранние сроки, коэффициент анизотропии уже на седьмые сутки достигает 94% от нормальных значений. Тенденцию к восстановлению прозрачности роговицы определяет ранняя нормализация экспрессии TGFβ-1 в собственном веществе роговицы и мобилизация микрососудов в области лимба с увеличением суммарной площади просвета капилляров на седьмые сутки эксперимента.
При акупунктурном введении ДБА активируются механизмы репаративной регенерации роговицы путем мобилизации микроциркуляторного русла области лимба. На фоне нормализации уровня PCNA двуслойный эпителий роговицы формируется уже на седьмые сутки эксперимента. В эти же сроки достигает нормы экспрессия фактора TGFβ-1 в собственном веществе роговицы, снижая вероятность развития фиброза в зоне его химического ожога. Коэффициент анизотропии коллагеновых волокон на седьмые сутки достигает 63 % от нормы, отражая динамику восстановления функционально адекватных структур.
Практические рекомендации
Возможность стимуляции репаративной регенерации стромы и эпителия роговицы и при локальном и акупунктурном введении биоматериала Аллоплант как модель регенерации соединительной и эпителиальной ткани позволяет рекомендовать данные технологии в комплексной терапии различных заболеваний, где требуется восстановление соединительнотканных формаций и эпителиальных структур.
Активация терминального сосудистого русла в области лимба позволяет на фоне локального и акупунктурного введения биоматериалов Аллоплант рекомендовать данные методы при лечении дистрофических и дегенеративных поражений.
Фармакопунктура диспергированным биоматериалом Аллоплант может быть использована в практике рефлексотерапии с целью достижения пролонгированного эффекта и профилактики и рассасывания рубцов в области биологически активных зон кожи.
Список работ, опубликованных по теме диссертации:
-
Фармакопунктура диспергированным биоматериалом «Аллоплант» /Э.Р. Мулдашев, Р.Т. Нигматуллин, Р.Ф. Галияхметов, А.М. Дусалимова, Р.З. Кадыров, Н.И. Валиева // Материалы XIV Международной конференции: «Циклы природы и общества», Ставрополь, 2006. – С. 76-77.
-
Применение диспергированного биоматериала «Аллоплант» для акупунктурного введения в клинической практике / Э.Р. Мулдашев, Р.Т. Нигматуллин, Р.Ф. Галияхметов, А.М. Дусалимова, Р.З. Кадыров // Материалы Третьего Международного тихоокеанского конгресса по традиционной медицине, Владивосток, Сеул, 2006. – С. 30-32.
-
Стимуляция репаративной регенерации роговицы диспергированными биоматериалами / Э.Р. Мулдашев, Р.Ф. Галияхметов, Р.З. Кадыров // Сборник научных статей: «Современные методы диагностики и лечения заболеваний роговицы и склеры», Москва, 2007. – С. 96-102.
-
Репаративная регенерация роговицы при акупунктурном и перилимбальном введении биоматериала Аллоплант / Э.Р. Мулдашев, Р.Т. Нигматуллин, Р.Ф. Галияхметов, Р.З. Кадыров, А.М. Дусалимова // Сборник научных трудов конгресса, посвященного 30-летию со дня открытия Центрального научно-исследовательского института рефлексотерапии, Москва, 2007. – С. 319-320.
-
Морфологические аспекты фармакопунктуры с использованием биоматериалов / Э.Р. Мулдашев, В.У. Галимова, Р.Ф. Галияхметов, А.И. Кирилличев, А.Е. Апрелев, Р.Т. Нигматуллин // Морфологические ведомости, № 3-4, Москва, 2007. – С. 128-130.
-
Некоторые закономерности биодеградации трансплантатов / Р.Т. Нигматуллин, В.Г. Гафаров, Р.Ф. Галияхметов, А.Р. Мухаметов, А.Е. Апрелев, Д.А. Щербаков // Морфологические ведомости, № 3-4, Москва, 2007. – С. 130-132.
-
Роль тканевого напряжения при пересадке аллогенных трансплантатов / Р.Т.Нигматуллин, Р.Г.Гафаров, Р.Ф.Галияхметов, Н.Н.Аслямов, А.Р.Мухаметов, И.Р.Ишмуратова, З.Р.Мухаметова // «Вестник» Оренбургского государственного университета. – Оренбург, декабрь 2007. – С. 147-150.
-
Поляризационно-оптический анализ в исследовании аллогенных тканевых трансплантатов / Р.Т.Нигматуллин, В.Г.Гафаров, Р.Ф.Галияхметов, Н.Н.Аслямов, А.Е.Апрелев, З.Р.Мухаметова // Морфологические ведомости № 2, Москва, 2008. – С.95.
-
Реактивные изменения в гиподерме при введении биоматериала Аллоплант / Э.Р.Мулдашев, В.У.Галимова, Р.Т.Нигматуллин, А.И.Кирилличев, А.Е.Апрелев, Р.Ф.Галияхметов // Морфологические ведомости №3, Москва, 2008. – С.77-78.
-
Сравнительный анализ физических методов идентификации биологически активных точек / Р.Ф. Галияхметов, Л.Ф.Агеева // Сборник материалов XVI Российского национального конгресса «Человек и лекарство». – Москва, 2009. – С.531.
-
Стимуляция репаративной регенерации роговицы перилимбальным и акупунктурным введением биоматериала Аллоплант / Р.З. Кадыров, Р.Ф. Галияхметов, Д.А. Щербаков // Материалы научно-практической конференции: «Экологическая медицина и офтальмология». – Москва, 2009. – С. 95-97.
-
Клеточные и сосудистые реакции при подкожном введении биоматериала / В.У. Галимова, Р.Ф. Галияхметов, Н.И. Валиева, Д.А.Щербаков, Л.Ф.Агеева, А.Е. Апрелев // Морфологические ведомости, № 3, Москва, 2009. – С.278-279.
-
Стимуляция репаративной регенерации роговицы перилимбальным введением биоматериала / Р.З. Кадыров, Р.Ф. Галияхметов, А.Б. Нураева // Морфологические ведомости № 3, Москва, 2009. – С. 256-258.
к содержанию | опубликовать статью
АНАТОМИЧЕСКОЕ ОБОСНОВАНИЕ ХИРУРГИЧЕСКОЙ КОРРЕКЦИИ ПТОЗА ВЕРХНЕГО ВЕКА ПРИ ОФТАЛЬМОПЛЕГИИ
Галимова В.У., Салихов Э. А.
Работа выполнена в ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию» и ГОУ ВПО «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Впервые для устранения птоза верхнего века при офтальмоплегии использовано лобное брюшко надчерепной мышцы, в которое пересаживается сухожильный аллотрансплантат и диспергированный биоматериал Аллоплант. Изучены результаты клинического применения разработанного метода устранения птоза верхнего века.
Анатомические термины и их сокращения, использованные в работе
Venter frontalis M.epicranius – лобное брюшко надчерепной мышцы – V. frontalis M.E.
M.occipitofrontalis – затылочно-лобная мышца – термин приводится без сокращения
Galea aponeurotica - сухожильный шлем (надчерепной апоневроз) – G.aponeurotica
M.corrugator supercilii - мышца, сморщивающая бровь - термин приводится без сокращения
M.orbicularis oculi (pars orbitalis) - круговая мышца глаза (орбитальная часть) – M. orbicularis oculi (P.O)
M. levator palp. superior – мышца поднимающая верхнее веко – M. levator P.S.
Актуальность работы
Топографическая анатомия лица составляет основу для разработки восстановительных операций в данной области (Рауэр А.Э., 1954). Если до недавнего времени традиционная макроскопическая анатомия полностью отвечала запросам хирургии, то в последние годы активно развивающаяся микрохирургическая техника потребовала разработки макро-микроскопической анатомии. Данная тенденция в большой степени коснулась хирургии области лица, так как современная офтальмохирургия, нейрохирургия, пластическая и челюстно-лицевая хирургия уже манипулируют в сфере малых увеличений от 5 до 20 раз (Каган И.И., Канюков В.Н., 1999). Очевидно, что дальнейшая разработка макро-микроскопической анатомии лица, его различных топографических областей необходима для развития указанных разделов хирургии.
В качестве объекта настоящего исследования были выбраны соединительнотканные структуры и мимическая мускулатура лобной области. Связано это с прикладным характером работы, и, в частности, с необходимостью анатомического обоснования коррегирующих операций при птозе верхнего века на фоне офтальмоплегии. Данная патология нами выбрана ввиду высокого процента рецидивов при традиционных методах лечения, а птоз при офтальмоплегиях практически не поддается хирургической коррекции (Зайкова М.В., 1980). При указанной форме птоза невозможно выполнить традиционное хирургическое вмешательство на мышце, поднимающей верхнее веко ввиду её функциональных ограничений. Поэтому нами изучены возможности мобилизации мышц с иными источниками иннервации для восстановления леваторной функции верхнего века. Учитывая, что в литературе имеются указания на возможность использования для данных целей лобного брюшка надчерепной мышцы, нами были предприняты целенаправленные топографо-анатомические исследования в лобной области (Han K., Kand J., 1993).
Однако, для разработки техники хирургического вмешательства с целью восстановления динамических функций верхнего века недостаточно знания макро-микроскопической анатомии орбитальной и лобной областей. Подобные реконструктивные операции, как правило, требуют использования адекватных трансплантатов. Поскольку в данном случае речь идет о фиксации верхнего века к лобному брюшку надчерепной мышцы, встает вопрос выбора соответствующего пересадочного материала. При этом мы учитывали результаты исследований сотрудников Всероссийского центра глазной и пластической хирургии, в которых обосновывается использование аллогенных сухожильных трансплантатов для выполнения подобных хирургических вмешательств (Мулдашев Э.Р., 1996). Поэтому, нами были выбраны биоматериалы для фиксирующей пластики, изготовленные на основе аллогенного сухожилия, которые обладают высокими показателями модуля упругости и предела прочности и потому наиболее оптимальны для выполнения фиксирующих и подвешивающих операций (Мулдашев Э.Р., Салихов А.Ю., Галимова В. У., 1995-2003).
Однако, в указанных работах не изучены реактивные процессы, происходящие при пересадке аллогенного сухожильного трансплантата в мышечное ложе. Поэтому, в экспериментальном разделе работы изучены явления морфогенеза при интрамускулярной пересадке двух видов сухожильного аллотрансплантата – в структурированной и диспергированной форме. Структурированный трансплантат готовился по требованиям технических условий 9431-001-27701282-2006, диспергированный по ТУ42-2-537-2006.
Учитывая относительно слабое развитие мимических мышц, в качестве ложа для проведения экспериментальной пересадки указанных трансплантатов, были выбраны мышцы голени лабораторных крыс.
Таким образом, для создания и внедрения новых пластических операций в области век и орбиты мы исходили из двух теоретических принципов: с одной стороны – исследование макро-микроскопической анатомии данной топографической области, с другой стороны – выбор и обоснование адекватного трансплантационного материала с учетом задач хирургического вмешательства.
Исходя из приведенных данных, нами сформулирована следующая цель настоящей работы: на основе результатов исследования топографической и функциональной анатомии мышц и соединительнотканных структур лобной области, разработать новые восстановительные операции при птозах верхнего века с применением биоматериалов Аллоплант.
Методы анатомического и функционального исследования мышц и соединительнотканных структур лобной области. Для проведения топографо-анатомических исследований нами был использован материал, полученный от 18 трупов людей обоего пола, скоропостижно скончавшихся в зрелом возрасте и не имеющих видимых патологических изменений в области лица. На первом этапе производилось макро-микропрепарирование орбитальной и лобной областей с докраской тканей пикрофуксином по А.П. Сорокину (1973).
Для исследования были выбраны три топографические зоны: медиальный, срединный и латеральный участки лобной областей. Размеры образцов были следующие: ширина – 10 мм, высота – 20 мм. При этом забирались все слои тканей от кожи до надкостницы. Топографические срезы готовились в сагиттальной и горизонтальной плоскостях, окрашивались по методу Маллори, по Ван-Гизону, по Харту, а также гематоксилином и эозином в соответствии с рекомендациями, приведенными в руководстве по микроскопической технике (Саркисов Д.С., 1996). Препараты изучались с помощью исследовательского поляризационного микроскопа МИН-8. Для микрофотографирования применяли микрофотонасадку МФН-10. Количественное соотношение мышечных волокон и соединительнотканных структур в различных топографических зонах определяли с помощью аппаратно-программного комплекса, включающего микроскоп МС50, цифровой фотоаппарат с адаптером, персональный компьютер и программу Biovision Professional 3.0.
Для определения функциональных возможностей мимических мышц лобной области нами был разработан функциональный тест, который мы условно назвали «фронтальным тестом». Тесты проводились на 28 лицах обоего пола, зрелого возраста. Для сравнения с нормой нами выполнен описанный выше «фронтальный тест» на пациентах с некоторыми видами патологии области орбиты.
Для исследования анатомического строения venter frontalis M.epicranius при различных функциональных состояниях нами использовался метод магнитно-резонансной томографии. Исследования проводились на магнитно-резонансном томографе «Opart» фирмы «TOSHIBA» с напряженностью магнитного поля 0,35 Тесла. Т1 и Т2 взвешенные изображения с толщиной среза равной 3 мм в трансверзальной проекции и 7 мм в сагиттальной проекции.
Данные исследования были проведены на 19 пациентах обоих полов в возрасте от 24 до 35 лет.
Методы экспериментального исследования при трансплантации аллогенных сухожильных биоматериалов. Данный раздел работы выполнялся на 86 половозрелых крысах породы «Вистар». В первой серии опытов лабораторным животным производилась аллотрансплантация сухожильного биоматериала в форме нити в толщу камбаловидной мышцы. При этом аллогенная сухожильная нить, диаметром 0,5-1,0 мм с помощью иглы проводилась через мышечное брюшко камбаловидной мышцы и фиксировалась узловыми швами в месте вкола иглы к брюшку мышцы и к пяточному сухожилию. Во второй серии опытов также пересаживался аналогичный сухожильный биоматериал, однако ложе биоматериала дополнительно обкалывалось диспергированным биоматериалом «Стимулятор регенерации». Аллотрансплантат «Стимулятор регенерации» в количестве 50 мг разводился в 5-10 мл физиологического раствора и вводился перифокально в область дефекта в две точки по 0,02-0,04 мл.
Биоматериалы готовились в тканевом банке ФГУ «Всероссийский центр глазной и пластической хирургии Федерального агентства по здравоохранению и социальному развитию» (г. Уфа) в соответствии с требованиями ТУ 42-2-537-2006 (диспергированный биоматериал «Стимулятор регенерации») и ТУ 9431-001-27701282-2006 (аллогенный сухожильный биоматериал для фиксирующей пластики), с учетом видовой специфичности.
Динамику структурных изменений изучали на 3, 7, 14, 30 и 90-е сутки эксперимента. Гистологические срезы сухожилий аллотрансплантата и мышечного ложа, полученные в разные сроки эксперимента, окрашивались по Ван-Гизону, гематоксилином и эозином, по Маллори, проводилась поляризационная микроскопия. Исследование проводились на микроскопе Micros (МС-50) с цифровой фотонасадкой Nikon. Полученные фотоснимки передавались с Flash-карты фотоаппарата в ПК для дальнейшей обработки. С помощью предварительно откалиброванной на объектив 40* программы Biovision производилось измерение толщины пучков коллагеновых волокон и размера ядер фибробластов. Полученные результаты автоматически переводились в программу Microsoft Office Excel 2003 для устранения производственных погрешностей, далее в программу Statistica 5.5 для построения графиков.
Материалы и методы клинического исследования. Под нашим наблюдением находилось 20 (21 глаз) пациентов в возрасте от 2 до 58 лет с диагнозом "Полный птоз верхнего века" различной этиологии. Из них мужчин - 6, женщин - 14. По этиологии заболевания пациенты были разделены на следующие группы в соответствии с классификацией птоза верхнего века (Брэк, Бертман дополненная Атомановым В.В. 2000г.):
1. Нейрогенный птоз (опущение верхнего века, произошедшее после черепно-мозговой травмы, бактериального или вирусного воздействия, вследствие чего поврежден либо глазодвигательный нерв, либо крупноклеточное ядро глазодвигательного нерва) – 13 пациентов (14 глаз).
2. Птоз верхнего века врожденный паралитический (связанный с парезом или параличом леватора верхнего века и парезом или параличом верхней прямой мышцы глаза, сочетается с патологией других экстраокулярных мышц) – 6 пациентов (6 глаз).
3. Один случай (1 глаз) птоз вследствие перенесенного идиопатического миозита. Во всех 20 случаях диагностировали птоз верхнего века тяжелой степени (величина птоза более 8 мм) - полный птоз верхнего века. При этом функция леватора верхнего века отсутствовала. Симптом (феномен) Белля был патологическим. Во всех случаях птоз верхнего века сопровождался наружной офтальмоплегией, то есть неподвижностью глазного яблока. У одного пациента птоз был двусторонний. Два пациента были ранее оперированы в сторонних клиниках по методике укорочения мышцы, поднимающей верхнее веко, и поступили без улучшения. Всем пациентам была выполнена операция по разработанной нами методике.
С учетом тяжести заболевания нами были приняты следующие критерии оценки функциональных результатов. Хорошим функциональным результатом считалась подвижность верхнего века более 6мм, величина птоза менее 2мм, лагофтальм отсутствовал. Удовлетворительным функциональным результатом считали подвижность верхнего века более 3мм, величина птоза менее 4мм, при отсутствии лагофтальма. К неудовлетворительным функциональным результатам отнесены случаи с подвижностью верхнего века до 3мм, величиной птоза более 5мм и наличием лагофтальма.
Методы статистической обработки клинического материала. В связи с особенностями организации наблюдений – регистрация изучаемых параметров либо по трем, либо только по двум срокам – для обработки данных использовали метод однофакторного дисперсионного анализа по Фишеру и методы сравнения сопряженных выборок (Плохинский Н.А., 1970). Так же применяли непараметрический (ранговый) медианный тест Уилкоксона (Холендер, Вулф 1983). Расчеты проводились при помощи соответствующих специализированных модулей программного пакета Statistica 5.5 (Реброва О.Ю., 2002).
Полученные результаты и их обсуждение
Как показали анатомические исследования, топография соединительнотканных и мышечных структур лобной области меняется в зависимости от уровня среза. Так, на уровне верхнего края лобного брюшка надчерепной мышцы поверхностная фасция имеет войлочное строение по классификации А.П. Сорокина (1973). Пучки коллагеновых волокон образуют рыхлую многослойную сеть, которая оплетается эластическими структурами. При этом пучки волокон различных слоев переплетаются между собой. В глубоких слоях поверхностная фасция без четких границ переходит в структуры эндо- и перимизия. На данном уровне апоневротический шлем формирует опору для мышечных пучков V. frontalis M.E. Само мышечное брюшко имеет пластинчатую форму толщиной в среднем 0,8 мм. Соединительнотканный футляр для мышцы формируется отрогами апоневротического шлема, которые в равной степени можно рассматривать как структуры поверхностной фасции. В описываемой плоской мышце содержатся все структурные элементы органа: эндо- и перимизий, описанный выше фасциальный футляр, органное сосудистое русло и иннервационный аппарат. В соответствии с задачами настоящей работы остановимся на строении соединительнотканных компонентов и мышечных пучков.
Отдельные мышечные волокна описываемой мышцы покрыты эндомизием, образованным тончайшими коллагеновыми волокнами. Толщина рыхлой прослойки эндомизия колеблется от 5 до 7 мкм. Мышечные волокна образуют пучки в 70-80 мкм, окруженные перимизием толщиной от 20 до 25-30 мкм. Рыхлая волокнистая соединительная ткань перимизия без четких границ переходит в фасциальный футляр (эпимизий). Все описанные соединительнотканные структуры формируют единую скользящую систему, которая создает оптимальные условия для сокращения мимической мускулатуры.
По мере приближения к орбитальному краю между дермой и поверхностной фасцией выявляется прослойка жировой клетчатки с развитой соединительнотканной стромой. Хорошо выраженные волокнистые пучки берут начало непосредственно от дермы и вдаются в жировую клетчатку, достигая поверхностной фасции. При этом часть мышечных пучков V. frontalis M.E., отделившись от основного брюшка, вплетаются в описанные соединительнотканные отроги и в их составе следуют до дермы. Таким образом, уже на уровне 25-30 мм от края орбиты образуются точки прикрепления для мышечных пучков лобного брюшка надчерепной мышцы.
Основная часть мышечных волокон V. frontalis M.E. следует ниже, как правило, до уровня орбитального края. Оформленное в верхней трети мышечное брюшко, приближаясь к орбите, распадается на отдельные волокна и тонкие пучки. Изменяется также и структура поверхностной фасции. Если в верхней трети - это рыхлая фасция войлочного типа, то в нижней части мышечного брюшка - это типичная фасция пучкового строения. При этом соединительнотканные структуры заметно превалируют в своем развитии над мышечными волокнами.
Сформированную таким образом структуру можно рассматривать как достаточно плотную фасцию пучкового строения с диффузно рассеянными в ней мышечными волокнами. Подобное образование специфическое, по-видимому, для мимической мускулатуры, мы предлагаем определить как мышечно-соединительнотканную пластинку. Примечательно, что данная пластинка в нижней части срастается с прилежащей дермой области орбиты, что подтверждает её опорную функцию для лобного брюшка. Описанное нами разделение мышечного брюшка V. frontalis M.E. на отдельные волокна связано с рядом причин. Прежде всего, в соединительнотканных промежутках между мышечными пучками появляется достаточное пространство для прохождения волокон круговой мышцы глаза. Кроме того, между разнообразно ориентированными мышечными волокнами (Venter frontalis M.E, M.orbicularis oculi P.O., M.corrugator supercilii) поверхностная фасция, уплотняясь, формирует межмышечные перегородки, которые следует рассматривать как отроги верхнеглазничного фасциального узла.
Данные межмышечные перегородки являются своеобразной опорой для мышечных пучков различных мимических мышц данного региона. Формирование описанной мышечно-соединительнотканной пластинки на наш взгляд связано со следующими факторами:
-подобная формация мягкого остова служит опорой для мимических мышц и в частности Venter frontalis M.E;
-гистотопографические взаимоотношения мышечно-соединительнотканной пластинки создают благоприятные условия для интеграции нескольких мимических мышц с разнонаправленной ориентацией пучков и образования их взаимной опоры (Venter frontalis M.E, M.orbicularis oculi, M.corrugator supercilii);
-фиксирующая и опорная функции мышечно-соединительнотканной пластинки лобной области усиливаются через её связи посредством отрогов с верхнеглазничным фасциальным узлом.
Таким образом, для Venter frontalis M.E. местом начала является galеa aponeurotica, местом прикрепления – дерма верхнего орбитального края в виде полосы в 20 мм шириной, межмышечные фасциальные перегородки, а также верхнеглазничный фасциальный узел. Подобные топографические взаимоотношения позволяют создать адекватное напряженное состояние для указанного фасциального узла (Сорокин А.П., 1973).
Разработанный и примененный нами в клинике физиологический тест на лобное брюшко надчерепной мышцы («фронтальный тест») показал широкий индивидуальный разброс в реализации функциональных отправлений данной мышцы. По данному критерию можно выделить два крайних функциональных типа. При первом типе сокращение лобного брюшка приводит к смещению вверх всех исследуемых точек. По-видимому, это связано с более жесткой фиксацией места начала мышечного брюшка к galea aponeurotica или с малой его подвижностью. При втором типе векторы смещения верхнего и нижнего рядов тестируемых точек направлены навстречу друг другу. Это связано с достаточно большим объемом смещения места начала лобной мышцы вместе с надчерепным апоневрозом.
Результаты фронтального теста нашли подтверждение и при магнитно-резонансной томографии. Лобное брюшко надчерепной мышцы может быть выявлено при исследовании в горизонтальной и сагитальной плоскостях. Толщина мышечного брюшка варьирует в зависимости от функционального состояния. В частности у пациентов со вторым типом функционального (фронтального) теста обнаруживается более выраженное утолщение мышечного брюшка при его сокращении. И, что особенно важно, для хирургии, место прикрепления мышечного брюшка заканчивается не всегда на уровне верхнего орбитального края. Встречается более редкий тип высокого расположения брюшка описываемой мышцы, что по нашему клиническому опыту не позволяет выполнить её низведение до верхнего края хряща век при хирургической коррекции птоза.
При разработке собственного метода хирургического лечения птоза нами использованы так же результаты экспериментально-морфологических исследований по трансплантации сухожильного биоматериала в мышечное ложе. Данный раздел исследований показал, что сухожильный аллотрансплантат после пересадки в скелетную мышцу подвергается структурной перестройке в соответствии с общими закономерностями заместительной регенерации (Коваленко П.П., 1970; Стадников А.А., 2003). Однако при этом наблюдаются процессы трансформации и в тканевом ложе. Так, со стороны эндо- и перимизия происходит пролиферация недифференцированных соединительнотканных клеток, которые активно мигрируют в направлении трансплантата. Одновременно происходит синтез всех компонентов внеклеточного матрикса волокнистой соединительной ткани. В результате новообразованные пучки коллагеновых волокон фиксируются к сухожильному аллотрансплантату. Таким образом, моделируются все структурные элементы мышцы как органа. Причем, наиболее активно данные процессы происходят при комбинированной пересадке сухожильного аллотрансплантата и диспергированной формы биоматериала.
Представленные результаты позволяют рассматривать имплантацию аллогенного сухожилия в мышечное ложе как способ созданием дополнительной опоры в скелетной мышце. Другими словами, аллосухожильный трансплантат - это не просто механически проведенная нить через мышечное брюшко, а дополнительно сформированная головка мышечного брюшка со всеми элементами её мягкого остова. К смоделированной таким образом опорной структуре можно надежно фиксировать любые анатомические образования. В нашем случае для коррекции птоза дополнительной точкой фиксации мышечного брюшка служит хрящ верхнего века.
Итак, две изложенные теоретические позиции легли в основу разработанного нами нового метода хирургического лечения птоза при офтальмоплегии:
-топографо-анатомические особенности лобной области и, в частности, наличие мышечно-соедиинительнотканной пластинки в области верхнего орбитального края;
-возможность моделирования дополнительной опоры для мышцы путем пересадки аллогенного сухожильного трансплантата в комбинации с диспергированной формой биоматериала.
Кроме того, важнейшим условием в разработке самой техники оперативного вмешательства при птозе на фоне офтальмоплегии является анализ источников иннервации экстраокулярных мышц глазного яблока и мимической мускулатуры. Так, при офтальмоплегии поражаются орбитальные мышцы и потому традиционные методы хирургического лечения, например, укорочение мышцы поднимающей верхнее веко, абсолютно не эффективны. Поэтому, при разработке собственного метода лечения, для реализации леваторной функции, нами было выбрано лобное брюшко надчерепной мышцы, иннервируемое самостоятельной ветвью лицевого нерва.
С учетом результатов проведенных анатомических и экспериментальных исследований нами разработана методика хирургической коррекции блефароптоза (заявка №2005106654/14(008106) от 28.02.05 г.). В её основе выделение мышечно-соединительнотканной пластинки на уровне верхнего края орбиты и формирование дополнительной опоры для мышечного брюшка с использованием аллосухожильного трансплантата. Выбор области фиксации вновь сформированного сухожилия определяется целью операции. При сохранении анатомической целостности хряща верхнего века, трансплантат фиксируется к его верхнему краю. В случае патологии хряща век первоначально производится его пластика с помощью каркасного трансплантата, а сухожильный биоматериал фиксируется уже к вновь смоделированному хрящу век .
Результаты проведенных нами клинических исследований показали высокую эффективность предлагаемой операции. Данный метод с успехом использован даже в случаях, когда пациент ранее оперирован и поступил в нашу специализированную клинику с рецидивом. В раннем послеоперационном периоде у пациентов наблюдался отек верхнего века оперированного глаза. Лагофтальм не наблюдался. Подвижность верхнего века была ограниченной вследствие отека. В ближайшем послеоперационном периоде функциональный результат - хороший у 10 пациентов, удовлетворительный - у 8 пациентов, не удовлетворительный – у 2 пациентов. Пациентам с неудовлетворительными функциональными результатами проводились повторные операции. В одном из случаев потребовалось «укорочение волокон Venter frontalis M.epicranius», операция выполнена через шесть месяцев. У одного пациента в раннем послеоперационном периоде наблюдался заворот верхнего века, вследствие атрофии хряща, и как осложнение кератит, выполнена каркасная пластика верхнего века по описанной нами методике. В отдаленные сроки до трех лет у 9 пациентов отмечен хороший функциональный результат, у 11 удовлетворительный. Не было ни одного случая лагофтальма. Таким образом, опыт выполнения предлагаемой операции в клинической практике полностью подтвердил результаты наших теоретических исследований.
Результаты математико-статистического анализа клинических результатов показали, что оперативное устранение блефароптоза по предлагаемой методике, достоверно, в сроки наблюдения до двух лет, приводит к резкому и устойчивому снижению величины блефароптоза, прогрессивно нарастающей подвижности верхнего века и, как следствие, сопровождается некоторым повышением остроты зрения в отдаленные сроки после операции и более выраженным и отчетливым расширением границ поля зрения.
Заключение и практические рекомендации
Мимические мышцы (Venter frontalis M.epicranius, M.orbicularis oculi, M.corrugator supercilii) и структуры мягкого остова лобной области (эндо- и перимизий, поверхностная фасция, апоневротический шлем, верхнеглазничный фасциальный узел и его отроги) формируют единый мышечно-соединительнотканный комплекс, обеспечивающий скользящие и опорные функции для всех анатомических структур региона.
Лобное брюшко надчерепной мышцы имеет две точки прикрепления:
- основную, в составе мышечно-соединительнотканной пластинки, фиксирующейся к дерме в области надбровных дуг;
- дополнительную, в виде отделившихся от основного мышечного брюшка в средней его трети и следующих в составе подкожных соединительнотканных тяжей к дерме выше надбровных дуг.
Специфическим элементом мягкого остова, реализующим его опорные функции в лобной области является мышечно-соединительнотканная пластинка толщиной 3,0-3,5 мм и высотой 20 мм, которая формируется на уровне надбровных дуг и включает следующие анатомические структуры: три мимические мышцы (Venter frontalis M.epicranius, M.orbicularis oculi, M.corrugator supercilii), плотный участок поверхностной фасции, хорошо развитые структуры эндо- и перимизия, отроги верхнеглазничного фасциального узла в виде межмышечных перегородок. Отношение площади мышечных пучков к соединительнотканным волокнам для описываемой пластинки лобной области составляет 0,33±0,021.
Векторы и объем смещения кожного покрова лобной области отражают индивидуальную изменчивость мимических мышц, что связано с вариациями в анатомическом строении лобного брюшка надчерепной мышцы и точек его фиксации. Фронтальный тест в комплексе с ЯМР-томографией мимических мышц может быть также объективным диагностическим критерием и показателем динамики восстановительных процессов после хирургических вмешательств в лобной области.
Пересадка аллогенного сухожильного трансплантата в мышечное ложе в комплексе с инъекцией диспергированной формы биоматериала приводит к формированию дополнительной опоры для мышечного брюшка со всеми соединительнотканными структурами мышцы как органа.
При отсутствии функции мышцы, поднимающей верхнее веко, в случае офтальмоплегии, возможно восстановление леваторной функции верхнего века путем мобилизации лобного брюшка надчерепной мышцы и пересадки сухожильного биоматериала Аллоплант.
Разработанный хирургический метод с использованием биоматериалов Аллоплант позволяет, в сроки наблюдения до двух лет, добиться стойкого функционального результата в коррекции птоза верхнего века, при этом избежать осложнений.
Практические рекомендации
Мышечно-соединительнотканная пластинка области надбровных дуг является адекватной анатомической структурой для формирования дополнительной опоры на основе аллосухожильного трансплантата и фиксации ее к хрящу верхнего века с целью хирургического лечения птоза.
При хирургических вмешательствах в области орбиты необходимо учитывать индивидуальную изменчивость мимической мускулатуры. В тех случаях, когда лобное брюшко надчерепной мышцы может низводиться до верхнего края хряща век, упрощается техника хирургического вмешательства при птозе. У части пациентов подобная мобилизация ввиду высокого расположения мимической мышцы не представляется возможной. В таких случаях целесообразно создавать дополнительную опору для мышцы в виде аллосухожильного трансплантата по разработанной нами методике.
В комплекс предоперационного и послеоперационного обследования больных с птозом верхнего века рекомендуется включить выполнение функционального теста на лобное брюшко надчерепной мышцы и при показаниях ЯМР-томографию в различных функциональных состояниях мимических мышц.
При разработке методов хирургической коррекции птоза верхнего века рекомендуется учитывать источники иннервации различных мышечных групп. Так, поражение экстраокулярных мышц исключает возможность выполнения традиционной операции укорочения мышцы, поднимающей верхнее веко. В то же время возможна полноценная компенсация леваторной функции верхнего века путем мобилизации лобного брюшка надчерепной мышцы, имеющей иной источник иннервации.
Рекомендуется для устранения птоза верхнего века при офтальмоплегии использовать хирургический метод мобилизации лобного брюшка надчерепной мышцы с применением сухожильных аллотрансплантатов.
Литература
- Лицо человека: аспекты хирургической и функциональной анатомии / Р.Т. Нигматуллин, А.Г. Габбасов, Ю.И. Кийко [и др.] // Морфология. – 2002. - Т. 121, № 2-3. – С.113.
- Некоторые аспекты экономической эффективности внедрения трансплантационной технологии Аллоплант в офтальмоонкологию / А.Ю. Салихов., Э.Р. Мулдашев, Р.З.Султанов, Э.А.Салихов // Новые технологии микрохирургии глаза: матер. юбилейной XV Российской науч.-прак. конференции, посвященной 15-летию Оренбургского фил-ла ГУ МНТК «Микрохирургия глаза» им. акад. С.Н.Федорова. - Оренбург, 2004. - С. 243-245.
- Салихов, А.Ю. Особенности замещения аллосухожильных нитей при офтальмоонкологических операциях / А.Ю. Салихов, В.У. Галимова, Э.А. Салихов // Междисциплинарный подход к диагностике и лечению опухолей орофарингеальной зоны, головного мозга и органа зрения: матер. Всерос. науч.-практич. конф. - Челябинск, 2005. - С. 56.
- Салихов, А.Ю. Значение окологлазничных фасциальных узлов в хирургии рака век / В.У. Галимова, Э.А. Салихов // Междисциплинарный подход к диагностике и лечению опухолей орофарингеальной зоны, головного мозга и органа зрения: матер. Всерос. науч.-практич. конф. - Челябинск, 2005. - С. 56-57.
- Пути моделирования опорных структур мягкого остова лица человека / Р.Т. Нигматуллин, В.Г. Гафаров, Ю.С. Хасанова [и др.] // Вестник Уральской медицинской академической науки. - Екатеринбург, 2005. - С. 17-20.
- Нигматуллин, Р.Т. Анатомо-функциональный диагностический комплекс для исследования век / Р.Т. Нигматуллин, Э.А. Салихов, Г.С. Утенова // Тезисы VIII съезда офтальмологов России. – М., 2005. - С. 513.
- Салихов, Э.А. Способ хирургического лечения птоза верхнего века при офтальмоплегиях c использованием биоматериалов Аллоплант / Э.А. Салихов // Новое в экспериментально-морфологическом изучении глаза: тез. Российской науч. конф. с международным участием. - Оренбург, 2005. - С. 95-96.
- Обоснование выбора биоматериалов Аллоплант для восстановления артифициальных дефектов и деформаций век и орбиты / Э.Р. Мулдашев, Р.Т. Нигматуллин, Э.А. Салихов [и др.] // Новое в экспериментально-морфологическом изучении глаза: тез. Российской науч. конф. с международным участием. - Оренбург, 2005. - С. 86-88.
- Нигматуллин, Р.Т. Топографическая и функциональная анатомия мягкого остова и мышц глазничной и лобной областей / Р.Т. Нигматуллин, Ю.С. Хасанова, Э.А. Салихов // Новое в экспериментально-морфологическом изучении глаза: тез. Российской науч. конф. с международным участием. - Оренбург, 2005. - С. 89-91.
- Салихов, А.Ю. Хирургическое лечение птоза верхнего века при офтальмоплегиях / А.Ю. Салихов, В.У. Галимова, Э.А. Салихов // Заболевания и травмы орбиты: матер. симпоз. с международным участием. – М., 2005. - С. 294-296.
Методические рекомендации
- Тендопластика с использованием аллогенных биоматериалов: Методические рекомендации / Р.Т. Нигматуллин, В.Г. Гафаров, В.У. Галимова [и др.]. - Уфа, 2005. - 52с.
Заявки на изобретение
- Способ хирургического лечения птоза верхнего века при офтальмоплегиях: Заявка №2005106654/14(008106) от 28.02.05 г. / Э.Р.Мулдашев, А.Ю.Салихов, Р.Т.Нигматуллин, В.У.Галимова, Э.А.Салихов.
- Способ восстановления функций повреждений скелетной мышцы: Заявка №2005126878 от 25.08.05г. / Э.Р. Мулдашев, Р.Т. Нигматуллин, В.Г.Гафаров, А.Р. Мухаметов, Э.А. Салихов, О.Р. Шангина.